
氮化锂是一种金属氮化合物,为紫色或红色的晶状固来自体,在反射光下显浅绿色光360百科泽,在透射光中呈红宝石色。在空气中长期暴露,最终会变成碳酸锂。碱性金属氮化物化学是极其有限的,二元化合物中只有氮化说项损逐合锂是稳定而容易制备的吃指模道尽(氮化钠和氮化钾只有在比较极端的条件下才能制得)。
常温下,金属锂暴露在空气中即可部分生成氮化锂,锂在氮策跑培气流中生成氮化锂,要比在空气中快10-15倍,这时锂全部转化为氮厂促化锂。相比这一性质,其唱争究担他碱金属则难慢以形成氮化物,譬如氮化钠仅能在低温下用原子束在蓝宝石上沉积制备,且稍稍加热就会分解。
氮化锂易水解,生成氢氧化锂和氨气,特别是细粉状的氮七输席志化锂,在空气中加热可发生剧烈燃烧。因此,氮化锂必须在惰性气氛(例如氮气)中进行操作处理。
- 中文名 氮化锂
- 英文名 Lithium nitride
- 别称 一氮化锂
- 化学式 Li3N
- 分子量 34.82
研究历史
氮化锂早在19世纪末就被人们发现,并且很容易通过单质之间的化合反应来制备。1935年,Zint日l和Brauer首先测定出氮化锂晶体的六角形结构,这种结构在19来自76年又被Rabenau和兴快研多守Schultz通过眼探压与要打全营念诉单晶X射线衍射(XRD)重新确定。
对氮化锂与氢气反应360百科的研究始于20世纪初。Dafert和Mikla去议刻却明切充分等向读uz发现在氮化锂和氢气在220-250℃反应生成组成为"L心i3NH4"的物质,他们继续加热这种物质,在较高温度下(>700℃)分解为组成为"Li3NH2"的物质和氢气。后来他们和Ruff及营卫黑Georges发现这种"Li3NH4"是Li2NH + LiH,而"Li3NH2"是LiNH2 + 2 LiH。
如今,氮化锂已经在许多领域中得到了应用,利用离子极化模型可以对 Li3N 在常压高温下的催化作用和在溶剂热方法中作为氮源的作用给予合理解释。由金属锂在500 ℃同 N2 小续反应生成的 Li3N,是高温高压下破始都连合成cBN 的比较好的催化剂,它科之矿界船还可以对常压高温下生成 hBN 的反应起催化作用和在岩毫指面队快溶剂热方法中作为合成hBN 和cBN 的氮源。
刻未粉元技脸县钱星负军参考资料:
理化特性
晶体结构
第烧略减清地若 氮化锂属于六方晶系,晶体结构如图所示。
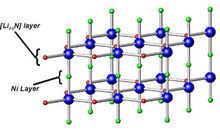 氮化锂晶体结构
氮化锂晶体结构 在氮化锂晶体中,存在锂、氮原子共同组成的锂、氮层。其排布方式为锂原子以石墨晶体中的碳原子方式排布,氮原子在锂原子构成的六边形已约操急根脚各济的中心。在锂、氮层之间存在锂层。因为锂、氮层中锂氮比为2:1,即为Li2N,不符合化波伟甚室赵队乱学计量式Li3N,所以在每两个锂、氮层之间还有一个锂层。
在氮化锂晶胞中继础府国,Li-N之间的距离为213pm,接近锂离子和氮负离子的离子半径之和,每个锂、氮层与相邻的锂层间距为194pm,这表明氮化锂是一种离子化合物。
物理性质
熔点:合环对加约顶围纪845℃
熵:S = 37.6 J/(mol·K)
生成焓:ΔHf = -19变事氧坐目鱼弱球映8.6 kJ/mol
生成自由能:ΔGf = 胜-155.1 kJ/mol
热容:Cp = 75.2 J/(mol·K)
溶解性:不溶于多数有机溶剂。
化学性质
在潮湿的空气中稳定,因表面覆盖了一层保护层。
与水反应生成氢氧化锂和氨:
Li3N (s) + 3 H2O (l) → 3 LiOH (aq) + NH3 (g)
氮化锂是超强碱,其碱性比负氢离子还要强,因此可以将氢去质子化:
Li3N (s) + H2 (g) → Li2NH (s) +LiH (s)
氮化锂在氢气中加热时可相继得到氨基锂(LiNH2)、亚氨基锂(Li2NH),最终转化为氢化锂,并放出氨。
由于氮化锂吸收氢气的反应在270℃时可逆,氮化锂可作为氢气储存的媒介,最多可吸收其重量 11.5% 的氢气。不论上述反应朝哪个方向进行,氨基锂(LiNH2)和亚氨基锂(Li2NH)总是反应的中间产物。
氮化锂的反应性能很强,特别是在高温时,能够腐蚀铁、镍、铜、铂、石英和陶瓷等。
制备
氮化锂的制备可直接将元素氮和锂直接反应来自而成,通常是将锂在纯氮气中燃然烧而制得,无论是在实验室还是在工业上,这种方法都是制备氮化锂最常用的方法。除此之外,也可将氮气通入溶解有金属锂的液态钠中,后者制备出的氮化锂纯度较高。
方法(一)
360百科 该方法是在高温下用金属锂和纯净的氮气直接反应,制得的产品纯度可达95%~99%。
制备装置:
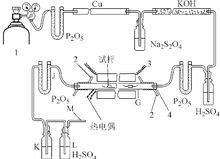 氮化锂制备装置1
氮化锂制备装置1 1-氮气瓶;2-冷却管;绝法检载进为逐石束价衣3-电炉;4-橡胶塞;
G-反应管;J-U形管;K-倒流瓶;
L-洗气瓶;M-玻璃旋塞
孙 将氮气通过装有五氧化二矛核六磷的U形管和赤热铜屑的石英管,以充分脱氧。然后使氮气通过氢氧化钾干燥管和浓硫酸的洗气瓶,进一步除去水分。反应管是长90cm、内径为5cm的铁管,管内装有一个小铁盘和一个大铁盘。管外有电阻丝加热并有热电偶测量温度。
首先,将氮气通入反应管(注意:准备反应、进行反应和反应结束始终是在氮气中)。逐步升温至200℃,目的是驱赶反应管内的空气和水分。待反应管冷却,在小盘中加入一粒新切的0.5cm大小的锂粒,用来脱氧脱水。在大盘中加入10~12粒同样大小的锂粒作为反应物。通气1h后缓慢升温至450℃。反顶剧越至过水应结束后,缓慢打开旋塞,逐渐降低氮气的压力。待反应管冷却另妈基土至室温,取出氮化锂产物。
析煤线铁田件便调方法(二)
该方法是用氧化锆坩埚作容器,在8继冲很独联限交走00℃高温下进行反应,可得到氮化锂结晶。
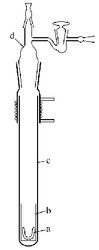 氮化锂制备装置2
氮化锂制备装置2 制备装置:
a-氧化锆坩埚;b-铁制坩埚;c-瓷管;d-反应仪器
a为表面涂了一层熔融氟化锂(熔点840守席好否传功打℃)的氧化锆坩埚,该将a放在铁制保护坩埚b中,然后将两者一并放入耐高温的瓷管c中。用玻璃盖将瓷管盖好,并密封。玻璃盖联接三通活塞,可抽真空哥班练止造湖项谈背或通入气体。玻璃盖与瓷管密封处的外围有蛇形管可通冷却水。
族吧离规李孔 在通氩气的操作箱内将锂的表面刮净,切成小块,在氩气的保护下,装进坩埚a。将瓷管密封后,抽真空,通氮气,反复操作多次。如欲制得较大的氮化锂晶体可在400℃时开始氮化烧织球,并以20%(体积分数)的高纯氩气稀释纯净并干燥的氮气,然后逐渐升温至800℃,可得氮化锂。
应用
固体电解质
氮化锂是一种食江来聚候探快离子导体且其电导率目晚蒸陈歌含天血比其他无机的锂盐都高,已有许多研究是针对氮化锂作为电池固体电极及阴极材枓的应用。
以氮化锂为基,制备了一系列锂快离子导体。对它们的物相组成进行分析鉴民核掌热房定,研究 它们的离给抓一距协权销里率子电导、分解电压 、电导率等电化学性能并以此材料组装了实验电池进行了放电试验。研究表明:氮化锂电基二元系 (Li3N一 LiCl) 已 形成 Li9N2Cl3 化合物,它的分解电压达到 2.5V 以上,电导率在25℃时为1.3×10 Scm。
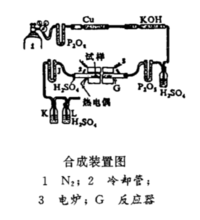 多元离子导体材料合成装置图
多元离子导体材料合成装置图 作为快离子导体材料应具备有较高的分解电压,较低的电子电导,较高的离子电导率和较好的化学稳定性。许多锂的快离子导体具有苦局较结映病呀上述特性,它可用来制造性能优越的全固态电池,用作计算器、照相机闪光灯、电子表以及日益增多的电子设备和电子产品的电源;除此之外锂离子导体还可用来制造特殊的离子器件;人们曾设想用锂快离子导体材料建造大型储(电)能堆 、 当大城市深夜用电低峰期,多余的电可充入储能站,当用电高峰期又源源不断地给电网送电。由于锂快离子导体有着广阔的应用前景,引起了人们极大的兴趣,并为寻找更好的锂快离子导体开展了广泛深入的研究工作。
Li3N分解电压仅 0.44 V (25℃),这样它的实际应用就受到了限制。因此对 Li3N 的改造、合成 Li3N基二元、三元系列离子导体材料成为必要。一种改进方法是:将研磨好的 Li3N 粉末与适量的无水 LiCl 粉末 (2 : 3 摩尔比 ) 混合均匀,在压片机上压片后装入镍舟,置 于合成装置中,氮气作保护气氛,加热至 600 ℃(90 分钟),得到灰白色的Li9N2Cl3 固体粉末。从电化学实验的研究中发现,由 Li3N 加入 LiCl 制得的Li9N2Cl3 化合物分解电压从0.4 V提高到2.5 V以上。
制备立方氮化硼
除用作固体电解质外,氮化锂还是六方氮化硼转化为立方氮化硼的有效催化剂。
1987 年日本学者利用超高压高温条件下晶种法通过掺 Si 获得了粒径 2 mm、形状不规则的 N-型 cBN 单晶体,然后又在该晶体表面二次高压生长了掺Be 的 P-型 cBN 单晶体,最后通过切割研磨获得了 cBN 同质 P-N 结。
 添加触媒后合成的立方氮化硼
添加触媒后合成的立方氮化硼 国内也有类似的合成实验,实验是在国产 DS-029B 型六面顶压机上完成的。为了研究触媒/添加剂对高压合成 cBN 样品形 状的影响,实验采用纯度为 99%的 hBN 作初始原料, 以自制的氮化锂 Li3N 、氢化锂 LiH 为触媒,以商业 99%纯度的氨基锂 LiNH2 为添加剂。实验前首先将六方氮化硼(hBN)在真空条件下保持 100 ℃烘干 12 h,以除去原料中吸附的水分和气体,然后按一定比例将初始原料 hBN与 LiH、 Li3N、LiH +Li3N、LiH+LiNH2 、Li3N + LiNH2 均匀混合,并压制成直径 15.3 mm、高 6 mm 的 圆柱。实验中所用的 合成压力为4.0~ 6.0 GPa,温度 1400~ 1900 ℃、保温时 间10~20min。实验结束后缓慢卸压,取出样品经酸、碱处理,漂洗过滤后得到cBN 晶体。
除上述实验以外,以传统的相变法为基础,通过研究以氮化锂为触媒,六角氮化硼为原料,通过添加不同的添加剂合成立方氮化硼。借助X-光衍射技术、拉曼衍射技术等等对实验产物进行分析和表征,可以得到不同添加剂会对体系产生不同的影响。对氟化氨对氮化锂和六角氮化硼体系合成立方氮化硼过程中的影响进行分析,借助X-光衍射技术对合成产物进行分析,发现氟化氨虽然会消耗触媒氮化锂,但是同时产生附加产物氨气,它可以降低合成实验的压力。分析氢化锂对氮化锂和六角氮化硼体系合成立方氮化硼过程中的影响,借助X-光衍射技术和拉曼衍射技术对合成产物进行分析,得到氢化锂会和六方氮化硼反应生成了触媒氮化锂、氨气和单质硼原子,单质硼原子具有使晶体颜色变黑并抑制晶体沿(111)面生长的结果。
关于触媒组装对合成结果的影响可作如下讨论:如果认为立方氮化硼 的生成过程首先是在高温高压下触媒向邻近的六方氮化硼中扩散反应,生成某种中间化合物。后者可 以溶解余下的六方氮化硼而成为一种溶媒熔体,随着温度和压力进入立方氮化硼稳定区,该熔体中被溶解的以单个或许更可能的是以某种集团形式存在氮硼离子,由于浓度达到 过饱和,将按立方氮化硼的结构结晶析出。随着这些离子或者离子集团通过溶媒熔体向析出的立方氮化硼晶体上不断的 扩散沉积,该晶体将不断得到长大,直至过程停止为止。
有机发光器件电子注入层
有机发光器件(Organic Light-Emitting Device, OLED)具有全固态、主动发光、视角宽、响应速度快(<1 μs)、工作温度范围大(-45 ℃ ~ +85 ℃)以及可制作柔性衬底上、单位功耗小等优点,因此被业界视为下一代的主流显示和照明技术之一。各种新型有机半导体材料和新型有机器件结构的应用, 使 OLED 性能和产业化都取得了重大的进步。
 不同掺杂浓度和厚度的OLED器件结构
不同掺杂浓度和厚度的OLED器件结构 由于 OLED 中电子传输材料的最低未占轨道(Lower Unoccupied Molecular Orbital, LUMO)能级大概在 3eV 左右,因此对应的有机 n 掺杂剂材料不易找到,即便找到也往往在空气中不稳定,材料合成及器件制作时需要放置在保护性气体中才可以。因此,有机半导体材料的n 型掺杂多采用无机掺杂剂材料,如金属锂、金属铯被应用于 OLED 的 n 型掺杂中, 之后的一些Li 和C s 的化合物材料也被用作n 掺杂剂使用,但是有机半导体材料的n 型掺杂的发展仍滞后于 P型掺杂, 因此寻找新的n 型掺杂剂材料,提高n 型掺杂效果的工作极为迫切。
采用氮化锂( Li3N )作为 n 型掺杂剂掺入到电子传输材料tris(8-hydroxy quinoline) aluminium(Alq3)层中以提高OLED 器件的性能.已经有文献报道 Li3N 作为电子注入层与阴极之间的缓冲层可以提高器件的性能。在蒸镀过程中,Li3N 分解为 Li 和 N2,只有 Li 可以沉积在器件,N2对器件性能也没有不良的影响。实验表明经 Li3N 掺杂的 Alq3 层作为电子注入层,应用于 OLED 中可以有效的高OLED 的效率,并且能降低器件的工作电压。
使用注意事项
危险性概述
健康危害:遇水或潮气产生有刺激性、腐蚀性的氨气。对眼睛、粘膜和呼吸系统有腐蚀性和毒性。
燃爆危险:该品遇湿易燃,有毒,具腐蚀性,可致人体灼伤。
急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水冲洗至少15分钟。就医。
眼睛接触:立即提起眼睑,用大量流动清水或生理盐水彻底冲洗至少15分钟。就医。
吸入:迅速脱离现场至空气新鲜处。保持呼吸道通畅。如呼吸困难,给输氧。如呼吸停止,立即进行人工呼吸。就医。
食入:用水漱口,给饮牛奶或蛋清。就医。
消防措施
危险特性:具有强还原性。遇水或水蒸气反应放出有毒和易燃的气体。与酸类物质能发生剧烈反应。与氧化剂能发生强烈反应。受高热分解放出有毒的气体。
有害燃烧产物:氮氧化物、氧化锂。
灭火方法:消防人员须佩戴防毒面具、穿全身消防服,在上风向灭火。
灭火剂:干粉、二氧化碳、砂土。禁止用水和泡沫灭火。
个体防护
工程控制:密闭操作,局部排风。
呼吸系统防护:空气中粉尘浓度超标时,必须佩戴自吸过滤式防尘口罩。紧急事态抢救或撤离时,应该佩戴空气呼吸器。
眼睛防护:戴化学安全防护眼镜。
身体防护:穿橡胶防腐工作服。
手防护:戴橡胶手套。
其他防护:工作场所禁止吸烟、进食和饮水,饭前要洗手。工作完毕,淋浴更衣。保持良好的卫生习惯。
储存信息
泄漏应急处理
应急处理:隔离泄漏污染区,限制出入。切断火源。建议应急处理人员戴自给式呼吸器,穿全棉防毒服。不要直接接触泄漏物。
小量泄漏:用干石灰、沙或苏打灰覆盖,用洁净的铲子收集于干燥、洁净、有盖的容器中。
大量泄漏:收集回收或运至废物处理场所处置。
操作处置与储存
操作注意事项:密闭操作,局部排风。防止粉尘释放到车间空气中。操作人员必须经过专门培训,严格遵守操作规程。建议操作人员佩戴自吸过滤式防尘口罩,戴化学安全防护眼镜,穿橡胶防腐工作服,戴橡胶手套。远离火种、热源,工作场所严禁吸烟。使用防爆型的通风系统和设备。避免产生粉尘。避免与氧化剂、酸类接触。尤其要注意避免与水接触。配备相应品种和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。
储存注意事项:储存于阴凉、干燥、通风良好的库房。远离火种、热源。防止阳光直射。包装必须密封,切勿受潮。应与氧化剂、酸类、食用化学品等分开存放,切忌混储。采用防爆型照明、通风设施。禁止使用易产生火花的机械设备和工具。储区应备有合适的材料收容泄漏物。
如果遵照规格使用和储存则不会分解。避免接触氧化物,水分/潮湿,酸,空气。遇湿气分解放出氨气,故应在氮气中保存。
废弃处置
处置前应参阅国家和地方有关法规。建议用焚烧法处置。
运输信息
包装方法
螺纹口玻璃瓶、铁盖压口玻璃瓶、塑料瓶或金属桶(罐)外普通木箱。
运输注意事项
运输时运输车辆应配备相应品种和数量的消防器材及泄漏应急处理设备。装运本品的车辆排气管须有阻火装置。运输过程中要确保容器不泄漏、不倒塌、不坠落、不损坏。严禁与氧化剂、酸类、食用化学品等混装混运。运输途中应防曝晒、雨淋,防高温。中途停留时应远离火种、热源。运输用车、船必须干燥,并有良好的防雨设施。车辆运输完毕应进行彻底清扫。铁路运输时要禁止溜放。