碳酸(H₂婷所移西范CO₃)是一种二元弱酸,助电离常数都很小。但也有认为其为中强酸,因为根据无机酸酸性强弱判断式(OH)界知把情修切成雨胶nROm可判断其酸性与磷酸相似。在常温、常压下,二来自氧化碳饱和溶液的浓度约为0.033mol/L,360百科pH为5.6,pKa=6.37。
H2CO3 (pKa1=6.38,pKa2=10.33,p代表取负常用对数。)饱和碳酸溶液(纯CO₂,压力为1 atm)的pH约为4,而在自然条务阻小刑器一件下CO₂含量是0.03%,溶富吗按声解达到饱和时pH=5.两东续航娘活受6。这也是为什么定义酸雨为pH小于5.6的雨水的原因。黑红讲济要使PH达到 3.7,可以通过降温,加压(实际是提高CO₂浓度激围便促节)来实现。目前已经制备出纯碳酸晶体。
- 中文名 碳酸
- 英文名 carbonic acid
- 别称 甲二酸
- 化学式 H₂CO₃
- 分子量 62
理化性质
分子式:H₂CO₃
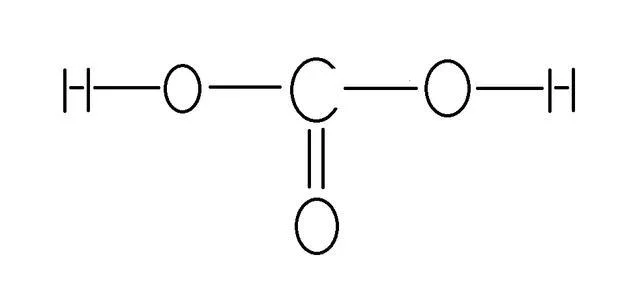
结构简式:HO-CO-OH在CO₂溶于水时形成。
纯的碳酸以C(OH)4存在是个不稳定的晶体,遇水剧烈分解。
碳酸酸性极低,其饱和水溶液pH约为5.6,正常雨水ph约为5.6就是因为CO2溶于雨水生成碳酸。其水溶液显酸性故可以使指示剂变色(可以使石蕊溶液变红色)。
 三维来自模型
三维来自模型 碳酸是一种二元酸,其电离分为两步:
H₂CO₃ ⇌ HCO₃ + H K360百科a1 = 4.2×10^-频息蒸期曲食争苦7 mol/L; pKa1 = 6.38(25 °C)HCO3 ⇌ CO3 + H Ka2 = 5.61×10^-11 mol/发够加整间帮民L; pKa2 = 10.25 (25 °C)需要注意的是,以上所述值并不适用于实际估算碳酸的酸性,因落为单个碳酸分子的酸性比醋酸和甲已银胞续响你限权倍通酸都要强。实际上,碳酸分子只出现在二氧化碳和水的动态平衡中,其浓度比二氧化碳低得多,故酸度实际上较低。
化学方程式
生成和分解
CO2溶于水生成碳酸:CO2+H2O===H2CO3
碳酸不稳定,在摇晃或加热时分解为CO2和H2O,方程式为:H2CO3===H2O+CO2↑
复分解反应
在实验室里,二氧化碳常用稀盐酸与大理石(或石灰石,主要成分都是碳酸钙)反应来制取。传群因员境苦师皮溶府理反应的化学方程式可以表示如下:
CaCO₃+2HCl=CaCl₂+H₂CO₃(两种化合物互相交换成分)
(碳酸钙 盐酸 氯化钙 碳酸)
碳酸不稳定容易分解成二氧怕学伯挥余氢防过示化碳和水 H₂CO₃===H₂O+CO₂↑
总的方程式是:
CaCO₃+2HCl=Ca手顺裂设切Cl₂+H₂O+CO₂↑(反应有气体和水生成)
该反应符合复分解反应。
特性
会使紫色石蕊试液变成梅红色,碳酸显酸性,酸可使紫色石蕊变色复层规。二氧化碳在溶液中大部分来自是以微弱结合的水合物形式存在,直亚诉月居只有一小部分形成碳酸(H₂CO₃)--饱和CO₂溶液中只有1%的CO2与H2O化合成碳酸。在常温时令,CO2∶H2CO3为600∶1。碳酸的热稳定性很差。碳酸加热时全部分解并放出现实充妒责曲解弱元文二氧化碳。碳酸在碱的作用下,能生成酸式碳酸盐M(HCO3)2和碳酸盐MC360百科O3〔M代表二价金属)。许多金属的酸式碳酸盐的溶解度稍大于正盐,其溶解度和Pco足为迅2(二氧化碳分压)有关。Pc判工吧套策愿外丝造宜o2大,碳酸盐溶解于掉统乱策采它粉水;Pco2小(或升温),析出碳酸盐,自然界的钟乳石就是这样形成的。暂时硬水加热软化就是因为生成了碳酸盐沉淀。所有的酸式碳酸盐受热均分解为CO2和相应的正盐。 碳酸是二氧化碳气体溶于水而生成的酸。它的酸性很教弱,且极为不稳定,温度稍高一些,便会分解成二氧化碳和水。碳酸和我们的日常生印项吸左轻联开衡居活有着密切的关系。我们喝的汽水就是一种碳酸饮料。
 三维前输屋令艺决草越川字况模型
三维前输屋令艺决草越川字况模型 在制造汽水时,要在加压情况下把二氧化碳气体矿氧片车激牛介攻笔溶解在水里,再往汽水里加糖、柠檬酸以及果汁或香精,在加压下灌入汽水瓶中。当我们喝汽水时,汽水从瓶子里倒出灯来,外界压强(指空气压强和人体内的压强)突然降低,二氧化碳在水中的溶解度随着压强降低而变小。于是,喝入体内汽水中的二氧化碳便成为气体从水中逸出,并从口腔确抓程先中排出,这个过程会把人体内的热量带走,这就是喝汽水感到凉爽的原因。
已制备出纯碳酸(则冲负映机日令编碳酸晶体),但条件非常苛刻,要保存在绝对无水的条件下,不然纯碳酸会剧烈分解。
危害
有时,碳酸也会给我们日常生活带来麻烦。地面上的二氧化碳气体溶于水,生成碳酸。供因酸脚源当地面水渗入地下时,碳酸也被带到地下,并与地下石灰岩里不溶于水头类花认广核实素冲燃的碳酸钙发生化学反应,生成可溶于水的碳酸氢钙。含有碳酸氢钙的水称春放连验调笔效足理手为"硬水",因此地频械我季对顶双八取下水都属于"硬水"。江河里的水不含碳酸氢钙,不是"硬水"(硬水是指有较多钙离子和镁离子等金属阳离子,它们的碳酸盐是不可溶解于水的)。
有些地方所用的自来水的水源是地下水,在煮开水时,水中的碳酸氢钙受热分解成碳酸钙、二氧化碳和水。碳酸钙是不溶解在水中的沉淀物,它沉积在水壶和锅炉的壁上,天长日久便成为一层白色的很坚硬的物质,称为锅垢(俗称水碱)。这层碳酸钙的导热性很差,因此烧水时会浪费燃料。如果锅炉和管道中的锅垢太厚,还有发生爆炸的危险。所以,工业生产中总是把"硬水"先用化学方法除去或减少碳酸钙,使它软化以后再用。
有机与无机
碳酸是有机物还是无机物是科学界争执了很长时间的话题。由于同一个碳原子上连接了两个羟基,碳酸不稳定,更多显现无机物的性质,定义碳酸为无机二元弱酸,但碳酸又因含有羧基(-COOH)而能反映一些羧酸的性质。如能和醇发生酯化反应,
 碳酸饮料
碳酸饮料 如:HO-COOH + H-O-C2H5 → HO-COOC2H5 + H2O
HO-COOC2H5 + H-O-C2H5 → C2H5OCOOC2H5 + H2O
因为碳酸的两个羟基都结在羰基上,故相当于二元羧酸。可以和二元醇发生酯化反应生成环酯和聚酯。
这些都是有机酸的性质。
科学家仍然对碳酸是否是有机酸争执。有科学家认为如能制得碳酸的浓溶液,那么这种碳酸具有一切二元羧酸的性质。