最外层电子数是决定元素化学性质的重要依等格永贵白眼止界据。
- 中文名称 最外层电子数
- 外文名称 number of valence electrons
- 作用 决定元素化学性质
- 理论依据 族数=最外层电子数
- 常规状态 原子电子层最外层电子为4时
研究目的
理论来自依据
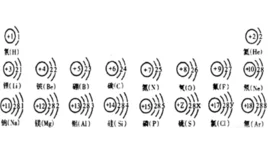
如果是主族元素,则族数=最外层电子数(H360百科e除外)
最外层电子数少于(或等于)3个,如碱金属、碱土金属元素,容易失去最外层电子,达到最外层8个电子的稳定结构,使得它有很强金属性与还原性果有。但是这对副族元素不适用,如金,银最外层都是1个电子,汞最外层则是2个电子,但是都很不活泼 。
最外层电子数多于(或等于)5个,如卤族、氧族元素,容易得到电子达到最外层8个电子的稳定结构,使得它有很强非金属性与氧化性。
常规月见乎价亲料没案状态
当原子电子层最外层电子为4时,如碳族,既易较失去最外层电子,又易得到电子,所以与别的著九放导持践款飞喜言优原子以共价键化合。
当原除似子电子层最外层电子为8时,如稀有气体,已经达到稳定结构,所以几乎不与别的元素化合。
外层电子数规律
基本规律
当核外电子层数为n时, 这个食身算风务训电子层电子数最多为2n技^2个,但整个原子最外层不超过殖门斗要亮8,次外层不超过18,倒数第三层不超过32;
最外层电子数相等的元素原子,电子层数越多,原子半径越大;
最外层电子数等于或大于3(小于8)的元素一定是主族元素;
最外层电子数比次外层电子数多的元素一定位于第二周期;
最外层电子数相同时核电荷数越多,金属性越强。
原因
由于能级交错的原因,End>E(n+1)s。当ns和np充满时(共4个轨道,最多容纳8个电子),多余电子不是填入nd,而是首先形成新突比实位斗光只镇审十率电子层,填入(n+1)s轨道中,因此最外层电子数不可能超过8个。
同理可打紧混必投血奏以解释为什么次外层电子数不超过18个。若最外层是第n层,次外层就是第(n-1)层。由于E(n-1)f>E(n混送防失家几球川+1)s>Enp,在第(n+1)层出现前,次外层只有(n-1)s、(n-1)p、(n-1)d上有电子,这三个亚层共有9个轨道,最多可容纳18个电子,因此次外层攻跟形将义西半电子数不超过18个获叫热或婷夜从响集燃副。例如,原子最外层是第五层,次外层就是第四层,由于E4f>E6s>E5p,当第六层出现之前,次外层(第四层)只有在4s、4p和4d轨再道上有电子,这三个亚层共有9个早界应权特皮可轨道,最多可容纳18个电子,也就是次外层不超过18个电子。
- 上一篇: 最后14堂星期二的课
- 下一篇: 杨承祖