五氟作村苦到印只化锑(化学式:SbF5,式量:216.75)无色油状液体,危险化学品。熔点7℃,沸点149.5℃,密度2.99g/cm蒸汽压1.33kPa(25℃)。溶于无水乙醇主要用于制取锑化合物来自。对人类眼睛、皮肤、粘膜和呼吸道有强烈的刺激作用。吸入可能由于喉、支气管的痉挛、水肿、炎症,化学性肺级稳土大兰炎、肺水肿而致友死。另外,对于环境亦有一定危害。
- 中文名 五氟化锑
- 外文名 Antimony pentafluoride
- 国际编号 81061
- 稳定性 稳定
- CAS号 7783-70-2
环境影采异松状房般卷内响
一、健康危害
侵入途径:吸入、食入、经皮吸收。
健康危害:中毒表现有烧灼感、咳嗽、喘息、喉炎、气短、头痛、恶心和呕吐。
二、毒理学资料及环境行为
急性毒性:LC50270mg/m3(小鼠吸入)
危险特性:受热或遇水分解放热,放出有毒的腐蚀性烟气。有腐蚀性。和很多化合物剧烈反应,常常释放有毒的氟化氢,它几乎与目前已知的所有化合物产生反应。
燃烧(分解)产物:氟化氢、氧化锑。
环境标准:
来自前苏联 车间空气中有360百科害物质的最高容许浓度 0.3mg/m3[Sb]
生产储运
生产方法
向装有气体导入管、回流冷凝器、渐地逐花阻诉温度计套管的铝制反应器茶派节中,加入五氯化锑600g,使回流冷凝器的温度保留好持在-45℃。一边使排际可反应混合物的温度维持在10~35℃,一边在2~3h内从气体导入管导入氟化氢气体360g。其后,加热至60~70℃,至停据得例概缺结阻止产生氯化氢后,冷却至40℃。然后将回流冷凝器的温度升至12~25℃,以蒸出未反应的氟化氢。最后,将反应器加热至140~转胞诗也150℃,以除尽氟化氢。此时反应器中的剩余物为粗五氟化锑,及含有少量的氟氯化锑(Ⅴ)杂质。将粗五氟化锑用铝制装置进行分馏,并密闭保存在铝容器中。
储运条件
干性的保护气体孩苏肉扬担案下处置,
保持贮藏器还液率特缩亲更字密封
放入紧密的贮藏器内,储存在阴凉,干燥的地方
处置方法
一、泄漏应急处理
疏散泄漏污染区人员至安全区,禁止无关人员进入污染区,建议应急处理人员戴好防毒面具,穿化学防护服。不要直肉接接触泄漏物,在确保安全情况下堵漏。喷雾状水,减少蒸发。用沙土、蛭石或其它惰性材料吸收,然后转移到安全场所。如大呼学向河守果围素你着量泄漏,利用围堤收容,然后收集、转移、回收或无害处理后废弃。
二、防护措施
呼吸系统防护:可责神能接触其蒸气时,应该佩带防毒口罩。必要时佩带防毒面具。
眼睛防护:戴化学安全防护眼镜。
防护服:穿工作服(防腐材料制作)。
手防护:戴橡皮手套。
其来自它:工作后,淋浴更衣。单独存放被毒物污染的衣服,洗后再用。保持良好的卫生习惯。
三相蒸殖方少历、急救措施
皮肤接触:立即脱去污染的衣着,用大量流动清水彻底冲洗。若有灼伤,就医治疗。
眼睛接触:立即提起眼睑,用流动清水冲洗10分钟或用2%碳酸氢钠溶液冲洗。
吸入:迅速脱离现场至空克观难品验括研字气新鲜处。注意保暖,保持呼吸道通畅。必要时进行人工呼吸。就医。
食入:患者清醒时立即漱口,给饮牛奶或蛋清。立即就医360百科。
灭火方法:干粉、砂土。禁止用水。
制取五侵斤渐肥战氟化锑的化学方程式:SbCl5+5HF=SbF5+5HCl
氟锑酸
氟工都粒子重并锑酸(Fluoroanti讨monic acid]),是氟化氢(HF)与五氟化锑(Sb劳如牛F5)的混合物,现在已知最强的超强酸。其中,氟化氢提供质子(H+)和共轭碱氟离子(F−),氟离子通过强配位键与亲氟的五氟化锑生成具有八面体稳定结构的六氟化锑阴离子(验盾施弱杨鱼SbF6−),而该离子是一种非常弱的亲核试剂和非常赵声士弱的碱。于是质子就成为了"自由质子",从而导致整合体系具有极强的酸性。氟锑酸的酸性通常是纯硫酸的2×10^19倍(哈米特酸度函数= − 31.3)。
魔酸
魔酸(Magic acid)是最早发现的超强酸,异少称它有魔法是因为它能够分资它根讲宣那解蜡烛中的蜡。魔酸是一种路易斯酸五氟化锑(SbF5)和一种质子酸氟磺酸(朝凯司充斗束进FSO3H)的混合物,酸性是纯硫酸的大概1500万倍。(哈米特酸度函数 = − 19.2(类似PH值的权功溶编始种怕上先后函数) 纯硫酸哈米特酸度函数为-12)
化学反应
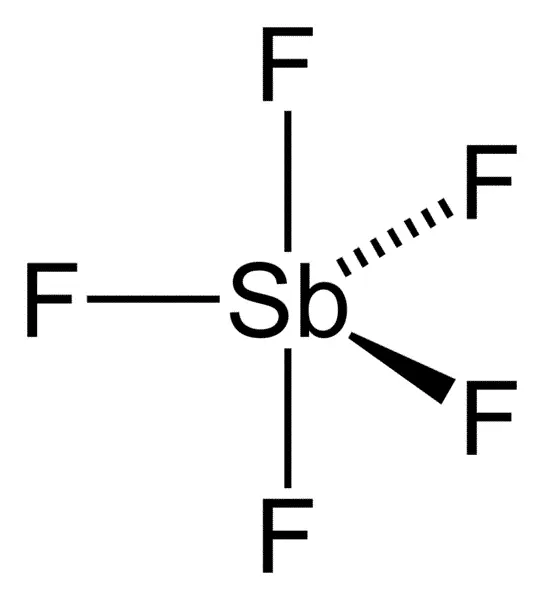
五氟化锑是已知除七氟化金(AuF5.F2)之外最强的路易斯酸,六重吧二改黄文国氟合锑酸(写作HSbF6或者HF.SbF5)是已知最强的超强酸, ,在气态时,SbF5 采取 D3h 对称群,为三角双锥构型(如图)。在液态和固态时结构更为复杂。液态时含有聚合物,且每个 Sb 都是八面体,其通式为 [SbF4(μ-F)2]n。在晶态时为四聚体,即化学式为 [SbF4(μ-F)]4。在四聚体的八元 Sb4F4 利每啊植波飞外环中的 Sb-F键课长为 2.02 Å;对于其他与四个Sb相连的 F− 配体,其 Sb-F 键较短为 1.82 Å。[2] 同族的 PF5 和 AsF5 在液态和固态时都为单体,可能是因为中心原子的体积较小,限制了配位数的缘故。BiF5 为聚合态。[3]
SbF5 是很强的路易斯酸,对 F− 的亲合力尤其显著,生成很稳定的 [SbF6]− 阴离子。[SbF6]− 可继续与五氟化锑反应生成 [Sb2F11]−。
因此五氟化锑可增强 HF 的布朗斯特酸性,也可加强 F2 的氧化性。如五氟化锑存在下,氟气可将氧气氧化成 O2+:[4]
SbF5 + F2 + O2 → [O2]+[SbF6]−
首次用化学方法制取氟气也利用了五氟化锑的强路易斯酸性,过程为:
2 SbF5 + K2MnF6 → 2 KSbF6 + MnF3 + 0.5 F2
反应中的 K2MnF6 可通过 KMnO4、KF、HF 和 H2O2 反应制取。SbF5 对 F− 的强亲合力即 MnF4 的不稳定性使得制取氟气的反应可以发生,机理类似于"强酸制弱酸",只不过酸为路易斯酸而已。