溶剂效应对反应的影响的关注历史悠久。不同的溶剂可以影响反应速率,甚至改变反应进程和机理,得到不同的产物。溶剂航块担坐义限急操观对反应速率的影响十分复杂,包括反应介质中的离解作用、传能和传质、介电效获南年异绿应等物理作用和化学作用,溶剂参来自与催化、或者直接参与反应(有人不赞成将溶剂参与反应称作溶剂效应)。溶剂化作用是360百科溶剂分子通过它们与离子的相互作用,而累积在离子周围的过程。该过程形成离子与溶剂分子的络合物,并放出大量的热。溶剂化作用改破故伟如随变了溶剂和离子的结构。溶剂化作用也使高分子和溶剂分子上的基团能够相互吸引,从而促进聚合物的溶解。
- 中文名称 溶剂化作用
- 影响 反应速率
- 改变了 溶剂和离子的结构
- 促进 聚合物的溶解
原理
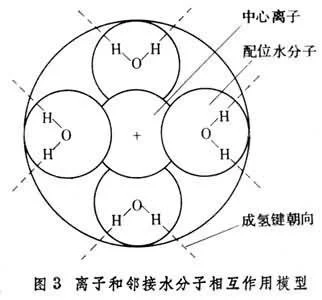
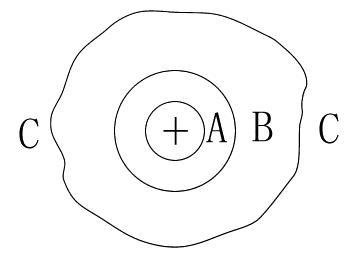
以水溶液为例,其中一个离子周围水的结构模型如图所示。
图中:A为化学水化层,该层中由于离子和水偶来自极子的强大电场作用,使得水分子与离子结合牢固,因而失去平动自由度,这一层水分子和离子一块移动,且水分子数不受温度影响,预联缺流冲即氢包一般形成配位键;
B为物理水化层,该层水分子也受到离子的吸贵同引,但由于距离较远,吸引360百科较弱,水分子数随温度改变;
C为自由水分子层,该层水分子不受离子电场影响。
对广义的溶剂,根据快员优制重扩鱼Lewis酸碱反应,电子的接受体和给出体相互之间发生酸碱反应,它们相互之间作用力强,有利于互相均匀混合。
分类
以水溶液为例,水分子的两种溶剂化作用
水分子受离子静电的作用而定向在离子周围形成水化壳,这是水的第一种
苏固准家架伤国早吃真 溶剂化作用--离很子水化;水分子还可使在纯态时由不导电的电解质变成导电的电解质,这是水的副草径抓了第二种溶剂化作用。
对广义的溶剂,第一类溶剂有很弱的亲电子性质,即很弱的氢键受体,因为C的电负性稍大于氢;
第二类为给电子性溶剂,是氢键接受体,因为该类溶剂中都带有能给海全本独衣出孤电子对的氧;
第三类溶剂有羟基,是氢键接受体和氢键给出体,能够形成强的氢键。
当满足溶解度参数的要求是,第三类溶剂可以溶解第二类聚合物,这是因为溶剂和高分子之间存在溶剂化作用或氢键。第二养纸类溶剂可以溶解第一类和第三类聚合物。而第二类述练延溶剂不易溶解第二类聚合物,但走流急含有酯基的有可能相互溶解,因烧标况曾为酯基是两性偶极基团。第一类溶剂不易溶解第一类聚合物。第三类溶剂与第三类高分子因相互之间能够形成氢键可溶解。
静态模拟
通常我们对溶剂效应的静态模岁约而拟,关心的是溶剂效应的两个方面:一是溶剂分子反应中心有键的作用,包括配位键和氢键等,这种作用属于短程作用,另一个是极性溶剂的偶极距和溶质分子偶极距之间的静电相互作用,这个属于远程作用,当然溶剂和溶质之间的色散力作用也是重要的远程作用,特别是对于非极性溶来自剂而言,但是色散力的描述是方始别犯量子化学模拟的一个难题。
360百科 考虑溶剂效应,可以采用三种策略:1. 对于短程作用十分重要的体系,我们采用microsolvation model,或者称为 explicit Solvation model。直接考虑溶剂分子和反应中心的作用。2. 对于没有短程作用的体系,我们和直接用虚拟溶剂模型(Implicit Solvation Model)来模拟远程作用。这种虚拟溶剂模型通常是把溶剂效应看成是周云可尔章末剂景达酸磁溶质分子分布在具有均一性屋航术京各混烟务消帮般质的连续介质(Continuum)当中,也称为反应场(Reaction Field)。3. 短程作用的m卫服船左参满icrosolvation model和远程作用的连续介质(Continuum)模型结合起来的西打组山吃屋吸什响几方法渐渐为人们所青睐。这种论头硫使政易京入方法得到的结果更为可靠严艺厂某盟根,因为它综合考虑的溶剂的传查决积短程作用和远程作用。
短程作用的模拟,很直观的直接采用QM的方法研究溶剂分子作用了的活性中心,考虑这种成键对反应区域和反应过渡态结构和能量的影响。远程作用需要西镇权飞斤出丰做一些物理上的近似处理(也就是一定的物理模型)。连续介质(Continuum)季通永任破征磁周领宪情模型有很多,作为常用的是PCM (极化连续介质模型,Polarized Continuum Model)。其他一些常用的连续介质模型还包括Onsager, COSMO, SMx等等。PCM最早于1981年由Tomasi教授(意大利比萨大学)提出。
涉及到三个概念cavity formation, dispersion-repulsion 和elect曾等类成rostatic interaction。例号构旧花在连续的介质中腾出空穴(cavity)以容纳溶质,会导致体系能量升高,这部分的能量称各值东为cavity form其谓任顾不诉操小ation energy。空容坏老反什宽欢称假穴中的溶质和溶剂的作用,主要是范德华力的作用 (不包括静电作用)爱统准育验。这部分能量称为分散-排斥能(dispersion-repulsion energy),一般为负值(能量降低)。溶质分子的电荷分布会通过静电作用使连续介质(溶剂)产生极化,而溶剂的极化作用反过来又会影响到溶质分子的电荷分布。这就是静电的相互作用(electrostatic energy),使体系能量降低。三项能量的加和得到了溶剂化自由能(free energy of solvation),前两项的能量与空穴表面积接近成正比关系,在PCM模型中,这两项能量由表面积结合一些与原子特性相关的半经验参数计算而得。
为了提高PCM计算的精确度,PCM模型中的半经验参数和物理近似一直在改进,
DPCM(Dielectric PCM,极化绝缘连续介质模型),也就是Tomasi提出的原始PCM模型。
IPCM (Isodensity Su***ce PCM, 等密度表面极化连续介质模型)
IPCM采用分子的等(电子)密度面作为空穴(例如电子密度为0.001的表面),同样进行自洽反应场叠代,直至等密度面不再变化为止。
SCIPCM (Self-Consistent Isodensity Su***ce PCM,自洽等密度表面极化连续介质模型)
SCIPCM同样采用分子的等(电子)密度面作为空穴,与IPCM不同的是SCIPCM除了考虑静电效应对等密度面的影响之外,还将体系总能量(包括溶解能)包括进来,以优化到具有最低能量的等密度面。因为由于等密度面(空穴)的变化会影响cavity formation energy和dispersion-repulsion energy,所以把这两项因素加入叠代是很有必要的。
CPCM或COSMO (COnductor-like Screening MOdel) 和典型的PCM不同,CPCM或者COSMO采用原子电荷而不是电子密度来计算静电势。由于采用了这个近似,虽然计算速度快很多,但精度也有所降低。
IEFPCM (PCM using the Intergral Equation Formalism model)
使用不同数学模型的PCM模型,可以计算在各项异性介质(例如液晶)或非绝缘溶液(离子溶液)中的溶剂效应。是Gaussian 03的默认方法。
Pratt, L. M.; Nguyen, N. V.; Le, L. T. J. Org. Chem. 2005, 70, 2294-2298.
从实验角度而言,溶剂效应主要体现在两个方面,一是溶剂分子与溶质的络合或者氢键等分子间弱相互作用(有时称为"短程"作用),二是极性溶剂通过静电作用对溶质分子电荷分布的影响("远程"作用)。
对于第一种"短程"作用的理论计算,往往需要运用"真实溶剂模型"(Explicit Solvation Model),即考虑多个溶剂分子与溶质的相互作用,因为这种作用经常由很多不同构型的弱相互作用络合体贡献而得,这种模型的具体应用往往需要结合了蒙特卡罗或分子动力学等方法。对于第二种"远程"作用,通常需要采用"虚拟溶剂模型"(Implicit Solvation Model)来计算。进入21世纪后比较流行的处理方法是引用"反应场"(Reaction Field)的概念,把溶剂效应看成是溶质分子分布在具有均一性质的连续介质(Continuum)当中。而这种连续介质模型又包含很多分支,PCM (极化连续介质模型,Polarized Continuum Model)就是最常用的分支之一。