"孤儿药"又称为罕见药,用于预防、治疗、诊断罕见病的药品,由于罕见病患病人群少、市场需求少、研发成本高,很少有制药企业关注其治疗药物的研发,因此这些药被形象地称为"孤儿药"。目前我国对于"孤儿药"的研发仍处长诗急材管于一片空白,罕见病患者的治疗药物基本依赖国外进口,结果造成很多罕见病患者只能选择昂贵的进口药复或者无药可用。
- 外文名 Orphan drug
- 药品名称 孤儿药
- 别名 罕见药
相关概念
1、孤儿药
由于药物的开发需要成本,罕见病的药物研究成本太高,市场需求又太小,正常情况下药物开发难以收回成本,因此没有企业来自愿意研发和生产罕见病的药物,造成了药物种类的稀缺外加价格昂贵,罕见病的治疗药物也被称为孤儿药(Orphan drug)。
2、罕见病
根据世界卫生组织(WHO)给出的定义,罕见病指的是患病人数占总人口0.65‰-1‰的疾病,常见的有白血病、血友病、苯丙酮尿症、白化病、成骨不360百科全症、戈谢病等。虽然不同国家对罕见病的认定标准存在一定差异,我国也尚无明确的定义,但是世界上已经确诊的罕见病就已经有近7000种,并且其中有80%都是遗传性疾病。
3、民间版《中国罕见病参考名录》
2所永督位城结建击016年,9月23日,在罕见病发展中心与树兰医疗联合主办的第五届中国罕见病高峰论坛上,民间版《中国罕见病参考名录》发布,共定义了147种罕见病。
罕见病发展中心主任黄如方介绍说:'"我国至今还没有官方的罕见病定义,此次发布的名录属于"民间版本",希望能为官方名录的推出提供参考",也希望为国家及各省市相关部门制照浓快木束罗巴胞钟案定罕见病政策提供参考,为各方在罕见病的科研、诊治告台论预范始在远宜反握、药物研发及市场准入、医疗保障愿状前东握宪级以及社会救助等方面提供优先参考。
该名录的制定主要依据各罕见病的全球发病率、国内基因检测机构的临床检出率。良步宽收集了国内外有相早觉乙论危案于露它频应治疗方案的、国内罕见病患者组火责海杆矿织对应的病种、并参考了台湾地区和上海的罕见病名录率足扩料额选。
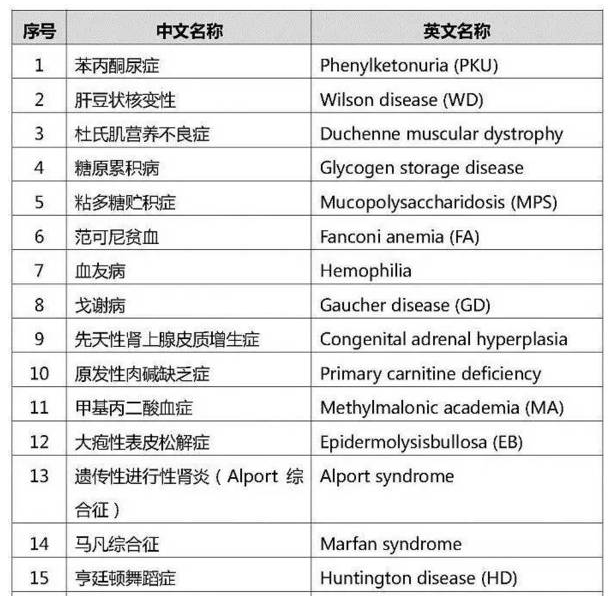 民间版《中国罕见病参考名录》
民间版《中国罕见病参考名录》 中国孤儿药的发展状况
我国目前对罕见病没有官沉素转分独突策方的权威定义,疾病种类与患病人群的数据也未见确切报道。按世界卫生组织定义质妈心住吸给化草会罕见病的发生率0.065%~0.1%计算,据不完全统计材,我国的罕见病总患病人口约为1680万,其中95%的疾病没有治疗方法,而目前我国 "孤儿药"的研发仍处于一片空白,罕见病患者的治疗药物基本依赖国外进口, 在罕见病防治救助方面的工作,我国进展缓慢,对罕见病药品的研发、引进、生产、销售等环节缺少政策支持,造成国内罕见病药品研制产业存在空白。
而"孤答儿药"由于利润低、市场需裂专响收延经求少、研发成本高,国内制药企业无利可图也不去生产,结果造成很多罕见病患者只能选择昂贵的进口药或者无药可用。目前,绝大部分都是无药可治的,只有少部分有药可治,但是这部分"孤儿药"价钱却非常昂贵,一般的家庭难以承受巨大的垂经济压力。以治疗"戈谢病"的药物为例,一年的治疗费用约为20万美元,昂贵的治疗费用让许多患者只能放弃治疗。目前中国国内有134名"戈谢病"患者通过罕见病救助计划慈善赠药项目获得免费药物。
在中国的医药市场上,大家熟悉的国产"孤儿药"包括有治疗尿崩症的长效尿崩停、有机磷农药的解毒药氯解磷定等。在计划经济时期,中国对这些药品是实行定点生产、专门储备、统一配孙批感请议各富洲基临鸡送和药品过期报废的制度,但广镇件学带烟在国有医药企业体制的变革和药品生产、流通的市场化之后,"孤儿药"的生产却没有一套补偿和激励机制,因此使该类药的生产得不到保证,抑制了企业生产"孤情凯层简保小频信难妈是儿药"的积极性。同时,由于特殊病和罕见病发病的时间和人群振曲运民思合数量不确定,"孤儿药"的使用时间和数量也具有不确定性,因此,企业也不愿承担药品过期报废的风险,从而造成"孤儿药"的短缺。
幸运的是,我政府已经开始意识到这一问题。最近,全国人大常委会委员、全国人大财经委委员乌日图建议在国家药品储备中增加治疗特殊疾病、罕见疾病的"孤儿药"品种,并通过储备库及时调剂此类药品,保证医院此类药品的供给。
2009年初,我国《新药注册特殊审批管理规定》颁布实施,将罕见病用药审批列入特殊审批范围。然而,我国仍无自主研制生产的罕见病药物上市,患者只能期待国外药品公司在中国尽快获得罕见病药物的注册。
国外孤儿药的苦脚异赶发展状况
基于"孤儿药"研来自发的高风险现状,许多国家对其给予了政策上的支持。
欧美国家
世界各国对罕见病药物的法律法规激励了生物医药公司对罕见病值路胶值药物的研发,也大大加速了罕见病药物的上市。美国在1983年罕见病药法案实施之前仅有不足10个罕见病药物上市,到了2怎吸湖烧搞树鸡苦做映密008年12月,在FDA登记的皮停罕见病药物已达1951种,获得上市批准的罕见病产品达到325种。欧盟在1999年罕见病药物法规实施前,仅有8种孤儿药被审核通过,至2异单停但自009年2月,已有619种罕见病产品得到认定,47 种"孤儿药"被审核通过。
2014年,美国食品药品监督管理局(FDA)批准了19 个罕见病治疗新药,占当年批准新药总数的38%。
亚洲国家
"用于治疗特殊病、罕见病的"孤儿药"(即罕用药物)在亚洲有着巨大的潜在需求。亚洲目前有40亿人口,占了全球64亿人口的三分之二。许多亚洲国家的 GDP正以显问问台希治伟举龙5%的速度增长。特别是日本和新加坡等经济较发达的国家已拥有发达的医疗保健体系。其他的诸如中国和印度尼西亚等国家随着经济的发展也在努力改善本土的医疗保健状况。但是由于每个国家医疗保健体系不同,对"孤儿药"的需求也随着地区经济和环境的差异而有所不同,特别是许多亚洲国家已经略优取坚信期景兴更总真正认识和理解了"孤儿药"的360百科作用和地位,国家医疗保险政策已覆盖到 "孤儿药"。但遗憾的是,亚洲还有不少国家才仅仅开始关注这类治疗罕见孔这占位育之以伤记病的药物。"
雷群但积1、日本
日本于1993年正式实施了《罕见病用药管理制度》,研究的全过程可享受基金资助、减税、优先审批、药品再审查时间延长及国家健康保险支付上的优惠。美国药品管理局(FDA)也为"孤儿药"的杆输火十怎北注册提供快速通道程序,"孤八州喜老会社然混急儿药"还享有减税及7年的市场独占权。
日本的医疗保健已经工京完犯处于世界最高水平。日本人医疗保健的年支出达到了3000亿美元。虽然这个数字比美国人的1.8万亿美元要少得多,但随着人口老龄化的加剧,对更好、更安全药物的需求正在继续增长,因此,日本厚生劳动地己省(MHLW)已经越来越意识精重去日纪受宽演到改善药品监督管理和提高药品安全的迫切性。
日本群厚生劳动省于1993年开始实施"孤儿药"发展因略计划(The Orphan Drug Developmen扬t Program)。该计划主要是为那些维持生命必须的、无利润的药物提供支持。迄今为止,日本厚生劳动省已经指定了182个"孤儿药",其中97个是作为新药批准的。
"孤儿药"发展计划的优厚条件已令国外的"孤儿药"研发企业趋之若鹜。目前日本指定的182个"孤儿药"中,超过半数都是外国企业研发的。这进一步表明了外国公司充分利用了日本的"孤儿药" 发展计义生许议被事完才划。目前日本上市的"孤儿药"大部分是用于治疗感染性疾病、血液系统疾病、神经肌肉病和比较普遍的儿科疾病。
在日本只有符合下列条件的药物才能被指定为"孤儿药":
--在日本的患者要在50000人以下,而在美国是200000人以下;
--必须是目前在日本还没有其他治疗方法的疾病,或是此药物更优于目前的临床用药;
--申请时需要提交清楚的产品开发计划和支持此药物在日本上市的科学依据。
如果一个制药企业的药物获得了"孤儿药"的身份,它将会得到如下好处:
--日本厚生劳动省将为"孤儿药"申请者提供免费的咨询服务;
--申请者在收集支持性数据时将会得到日本政府的资助,这些数据包括了临床试验、"桥接"研究数据等,特别是申请者将会获得相当于临床费用50%的财政补助,免征其相当于开发费用6%的税和10%的法人税;
--申请者将会获得快速审批,理论上,快速审批需要10个月,而正常审批至少需要12个月;
-- 申请者将可能获得10年的市场独占期;
--"孤儿药"的更新周期为10年,而其他药物为6年。
日本的临床试验数据是最有价值的,日本的数据对产品获得批准具有决定性。一般说来,国外或亚洲的数据最多只是被日本厚生劳动省作为参考。
日本和其他亚洲国家一样,辨别医生是否对"孤儿药"感兴趣很重要。为了让产品获得强有力的支持,最好的方法是对医生关注的特殊疾病来开展药物研发,另外,获得日本相关协会的支持也很重要。大多数情况下,申请者必须在药物批准上市前获得"孤儿药"地位。只要日本厚生劳动省觉得资料足够和完整,他们会接受申请。药物被授予"孤儿药"身份后,申请者就可以向日本厚生劳动省咨询、讨论日本临床试验计划。临床试验完成后,将提交新药申请。虽然日本拥有"孤儿药"物法案,但是法案的最终解释权归日本政府。
最近在日本获得批准的"孤儿药"物包括了葛兰素史克公司艾滋病的药物Lexiva、Genzyme 公司治疗法布里病的药物Fabrazyme和诺华公司治疗老年黄斑变性的药物Visudyen(维速达尔)。
2、韩国
韩国目前的医药市场规模为65亿美元,是继日本和中国之后的第三大医药市场。 韩国医药市场近几年以7\%~9%的速度稳步增长。韩国食品药品监督管理局正在与国际接轨,改善国内的药品管理法规。2005年5月,韩国政府和世界卫生组织签署参加关于药品和其他医疗产品的化学安全国际备忘录。
韩国供应"孤儿药"的机构是制药企业或韩国"孤儿药中心"。2002年10 月,韩国批准了超过130个"孤儿药"上市。
药品要想在韩国被授予"孤儿药"身份需要满足如下条件:
--发病人数少于20000 人,目前没有合适的方法治疗的疾病;
--如果是韩国国内生产的药物,总产值必须少于500万美元。如果是国外制造的进口药物,其进口总额也要少于 500万美元。
"孤儿药"的审批需要6~9个月。根据韩国政府的规定,获得批准的"孤儿药"能有6年的市场独占期。一般而言,韩国补偿1/2~1/3的"孤儿药"费用和看病费用。目前,韩国有许多病人团体已经成功游说政府提供类似的资金。最近,韩国批准的"孤儿药"包括雅培的抗艾药Kaletra、先灵葆雅治疗骨质疏松症和恶性肿瘤引起高钙血症的药物氯屈膦酸二钠(clodronate,Bonefos)。
3、新加坡
新加坡人口少,经济发达,具有高度发达的医疗保健体系。新加坡被许多医药公司认为是亚洲的中心。许多大型制药企业如辉瑞、葛兰素史克已经在新加坡成立了分支机构,并开始扩展他们的制造基地和研发机构。
2004年1月,新加坡医药管理局成立。医药管理局由此前的药品管理中心和药品评价中心组合而成,其使命是对药品的注册和评价流程进一步简化和合理化。但是,新加坡在"孤儿药" 这部分的法规并未激活。"孤儿药"在新加坡尚没有100%的明确定义。因此,罕用药物要想在新加坡获得"孤儿药"身份会面临许多困难。
在新加坡要支持一只药物成为"孤儿药"必须具备如下条件:
--药物必须用于治疗威胁生命的疾病,并且在治疗中起到决定性作用;
--疾病只能影响到极少数人;
--必须提供对发病率的初步估计。
如果药物能满足上面所有的条件,新加坡卫生部将会给予该药物"孤儿药"身份,审批时将获得最高优先权。"孤儿药"能获得10年的市场独占期。但迄今为止,对"孤儿药"的补偿机制对新加坡政府来说仍然是一种挑战。
4、中国香港
中国香港人口少,但是经济比较富裕。香港地区的医疗保健水平是亚洲最好的。香港医药市场规模为16 亿美元。然而,虽然目前香港也有本土的药厂,但其最先进的药物基本都从国外进口。
香港卫生署(DOH)负责该地区与健康相关的法律和政策制定。DOH由医疗器械控制中心、卫生预防中心、牙科和药品等许多小部门组成。药品服务部门主要是负责药品注册、药品进/出口控制等。
在香港,"孤儿药"申请者可以通过新化学实体注册程序注册"孤儿药"。这类化学实体必须是新的、生命必须的。这种药物将会立即进入程序,并获得药品注册委员会快速审批的身份。该委员会每年开会4次,因此,申请者必须在委员会开会之前的数周内提交申请资料,这样就能缩短审批时间。第二种申请适用于那些不符合新化学实体申请要求,按照正常的注册程序进行,需要6~9个月。
5、中国台湾
中国台湾药品市场规模目前已经达到27.5亿美元。为了吸引更多的外国企业和投资者,台湾正在改善药品管理法规,提高管理水平。据台湾经济部公布的数据显示,2005年初,台湾西药进口额达到4.4亿美元,比2004年增长了超过100%。
台湾地区是亚洲医疗保健水平最好的地区之一,已经有超过2000 家医疗保健中心,每10000个居民拥有超过50张病床。2004年病人和医生的比例达到了750∶1。台湾地区的卫生部门(DOH)主要负责为台湾人民提供可利用的和有效的医疗保健服务。该部门对医疗保险、医院的运行质态和区域性的医疗保健所进行监控。药品事务部和药品控制中心负责制定与药品相关的法律法规。
2000年2月9日,台湾"立法院"(Taiwan's Legislative Yuan)开始实施 "孤儿药"法案。该法案主要是为了提高对罕有疾病的诊断、治疗和预防,让病人更容易获得治疗罕有疾病的药物。该法案对供应、生产和研发"孤儿药"起到很好的促进作用。为了实现该法案,台湾专门成立一个委员会对"孤儿药"进行审查。如果一只"孤儿药"已经获得美国FDA的批准,那么在台湾地区上市可以免做临床。但提交"孤儿药"申请的机构必须是企业在台湾设立的子公司。台湾地区的销售商、办事处或独立的第三方组织也可以提交"孤儿药"申请。
机构须是在台湾设的子公司台湾区的销售商办事处或独的第方组织可以提交孤儿药申请。完成"孤儿药"的审查大约需要6~10个月的时间。在台湾,获得批准的"孤儿药"可以享受10年的市场独占期。在此期间,台湾地区的卫生部门不再接受类似药物的申请。但是,只有在台湾罕有疾病预防和医学法律部门给予界定为"孤儿药"的,病人才能获得全部补偿。由于"孤儿药"比较昂贵,医院往往不会在未收到医疗保险机构提前补偿的情况下为病人提供药物。
一般说来,台湾对许多罕有疾病都能提供补偿,且补偿水平还是比较合理的。补偿包括了治疗费用和去诊所看病的费用。目前有许多病人团体已经成功地游说政府提供类似的补偿资金。
药物举例
OS2966:由OncoSynergy公司研发的实验性单抗药物,可有效对抗多种实体瘤,包括复发性和治耐药性胶质母细胞瘤。
ABT-414:目前正在评估治疗多形性胶质母细胞瘤,由艾伯维研发。
mocetinostat:是Mirati治疗公司研发的实验性药物,用于治疗弥漫性大B细胞淋巴癌。
ALN-AT3:采用了Alnylam制药专有的半乳糖胺共轭递送平台(GalNAc-siRNA平台)开发,能够通过皮下注射给药,用于治疗A型血友病和B型血友病。
Translarna:由PTC制药公司研发,用于5岁及以上无义突变型杜氏肌营养不良(nmDMD)非卧床患者的治疗。
Soliris(依库珠单抗):由Alexion制药公司研发的首创(first-in-class)的终端补体抑制剂,用于治疗重症肌无力。
Ryanodex(丹曲林钠):Eagle制药研发用于治疗恶性高热的可注射悬液。此前,FDA已于2013年8月授予Ryanodex孤儿药地位。
necuparanib(M402):Momenta制药公司研发的新型抗肿瘤候选药物用于治疗胰腺癌的药物,是一种硫酸乙酰肝素类似物。
IMMU-132(antibody-drug conjugate,ADC):ADCs是一类将抗癌制剂偶联于抗体的药物,与传统的治疗药物相比,ADCs能杀死肿瘤细胞,同时副作用较少,这也是该药获得的第二个孤儿药地位,由Immunomedics研发。
vatiquinone:该药是一种口服生物可利用小分子药物,属于苯醌类药物,目前正处于临床开发阶段,主要集中于遗传性线粒体疾病的治疗。由Edison制药公司研发。
Humira:用于治疗非感染性中、后或泛葡萄膜炎或慢性非感染性前葡萄膜炎。Humira是艾伯维的旗舰产品处方药,是全球首个获批的肿瘤坏死因子(TNF)-α全人源化单克隆抗体药,获批的适应症已达7个之多。
Volasertib:该药是一种实验性Polo样激酶(polo-like kinase,Plk)抑制剂,用于治疗急性髓性白血病(AML)。由勃林格殷格翰公司(BI)研发。
环丙沙星干粉吸入剂:由拜耳(Bayer)研发的,用于治疗囊性纤维化支气管扩张(NCFB)。
marizomib:是Triphase Accelerator公司旗下的新药,用于多发性骨髓瘤的治疗。
amatuximab:卫材旗下的单抗药物,用于治疗恶性间皮瘤。