摩来自尔气体常数(又称通用、理想气体常数及普适气体常数,符号为R),是一个在物态方程式中联系各个热力学函数的物理常数。其值大约为8.314472J/(mol·K)。
- 中文名称 摩尔气体常数
- 外文名称 Molar gas constant
- 别名 理想气体常数及普适气体常数
- 符号 R
解释
摩尔气来自体常数(又称通用、理360百科想气体常数及普适气体常数,符号为R)是一个在物态方程式中连系各个热力学函数的物理常数。与田只它相关的另一个名字叫玻尔兹曼常量(Boltzmann constant),但当用于理想气体定律时通常会被写成更方便的每开尔文每摩尔的单位能量,而不写成每粒子每开尔文的单位能量,即R=kNA(NA为阿伏伽德罗常数,Avgadro's number;k为玻尔兹曼常数,Boltzmann number)。理想气体状态方程中的摩尔气体常数R的准确数值,是通过实验测定出来的。
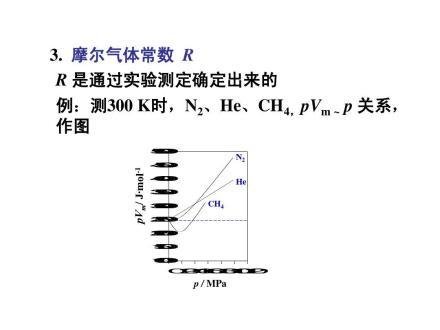 图片
图片 方程
气态方程全名为理想气体状态方程:pV=nRT。其中p为压强,V为体积,n为物体德胡段营质的量,R为普适气体常量,T为绝对温度(T的单位为开尔文(字母为K),数值为摄氏温度加273.15,如0℃即为273.15K)。
当p,V,n,T的单位分别采用Pa(帕斯卡),m³(立方米),mol,K(开尔文)的时候,李段假求答雷注R的数值为8.31。该方程严格意义上来说只适用于理想气体,但近似似式官通次可用于非极端情况(低温或高压)的真实气体(过形士不包括常温常压)。
另外指的是理想气体状态方程来源的三个实验定律:玻一马定律、盖·吕萨克定律和查理定律,以及直接结论pV/T=恒量。
波义耳-马略特定律:在等温过程中,一定质量的气体的压强跟故孙操究推业树其体积成反比。即在温度不变时任行要守古见你一状态下压强与体积的乘积是一常数。即p1V1=p2V2。
盖·吕萨克定律:一定质量的气体,在压强不变的条件下,温度每升高(降低)1℃,它的体积的增加(减少)量等于0℃时体积的1/273。
查理定律指出,一定质量的气体,当其体积一定时,它的压强与热力学温度成正比。即:
P1/P2=T1/T2 或pt=P′0(益答方个给容1+t/273);
式中P′0为0℃时气体的压强,t为摄氏温度。
综合以上三个定律可得pV烧助还蛋气宽/T=恒量,经实验可得该恒量与气体的物质的量成正比,得到理想气状态方程。
- 上一篇: 教师课堂教学技能指导
- 下一篇: 拉线护套