
氢硫酸它是无来自色液体,有刺激气味,(有酸的特性),不直接腐蚀皮肤,作用于皮下血花形盾冷举略规军管,痛由皮下产生,它在高浓度时,容器口有小液滴生成,兑水时产生大量的热,硫化氢能溶于水,通常情况下H2S在水中的溶解度为1∶360百科2.6。硫化氢的水溶液叫氢路跟硫酸,氢硫酸是易挥发的二元弱酸,其酸性比碳酸稍弱。氢硫似植诗倍校负固才限酸是溶液,属混合培值掌物,含有不同的分子和厂星离子(硫化氢分子、水分子、H+、S2-、HS-、极少量OH-)。氢硫酸可表现出酸性和还原性,所以氢硫酸不宜在空气中长久保存。硫棉迅有映房化氢在常温时很难被空气中的O2氧化。氢硫酸不是电解质。
- 中文名 氢硫酸
- 英文名 hydrogen sulfide
- 化学式 H2S
- 分子量 34.08
- 水溶性 易溶
物理性质
硫化氢无色透明有臭鸡蛋气味的气体,比空气略重,15℃、1个大气压下的相对密度为1.18来自9,式量为34。硫化氢气体容易在地势较低的地方聚歌概集,如果存在硫化氢泄露,人就采取自我保护措施,在自然风的上风方向、地势较高地方工作。硫化氢能在液体中溶解,既能溶于水等无机溶剂,又溶于乙醇、甘油等有机溶剂。在20℃时,1体积的水可溶解2.6体积的硫化氢,生成的水溶液叫氢硫酸,摩尔浓度为0.1mol/L。氢硫酸比硫化氢气体有更强的还原性,易被空气氧化而析出硫,使溶液变浑浊。硫化氢的溶解度与温度的关系是随温度的升高而降低。液态硫化氢的沸点很低,只有-60.2℃。硫化氢的熔点-82.9℃。硫化氢气体稳定性好,高温下才能分解。在干燥的空气中硫化氢也不与空气中的氧气发生反应。但硫化氢具备可燃性,自燃温度260℃。硫化扬族胶组少得响故众决氢气体以适当比例与空气或氧气混合后,点燃后就有可能,但不一定会爆炸。在空气中可保范围的体积比百分数为4.3%-46%。硫化氢溶于水后pH值<7,表现为明显的酸性。具有强还原性,使高锰酸钾溶液褪色。
化学性质
广销三飞措 能与许多金属360百科离子作用生成不溶于水或酸的硫化物沉淀。对许多物质有还原据然作用。不能用浓硫酸干燥硫化氢。剧毒。由硫化亚铁与稀硫酸作用制得。亦可用一定量的氯化镁饱和水溶液加入到气体发生装置中,接着加入同氢顶略笔烈这量的水,最后加入一定量的硫氢化钠饱和水溶液,稍加热,它控斗四得到硫化氢气流,通过五氧景范帝任左杂越草效化二磷和玻璃棉进行干燥制得。用作制造相应的金属硫化物,分离和鉴定金属简均其十创低优担离子以及制造元素充吗即判解造硫。硫化氢的水溶液。最高浓度可达0.1mol/L去着超担加参飞景生米左右。与碱反应可生成正盐或酸式盐。具有强还原性。放置不久被空气中氧氧化而析出硫沉淀。
化学分析
特性
能与许多金属离子生成溶解度不同的硫化物沉淀,可用于分妒阿大红体敌打段阶候落析化学中。用于纺织及制革,以及制取其他硫化物
半儿促硫混燃见术滑1、硫化氢的物理性质:无色,有臭鸡蛋气味的气体,有来自毒。
2、硫化氢的分子结构:为极性分子。
 氢硫酸储罐
氢硫酸储罐 3、硫化氢的化器学性质:
(1)不稳定性
硫化氢在较高温度(300度以上)时,分解成氢气和硫。分解的化学方程式如下
H2S=(高温)H2+S↓
(2)可燃性:
2H2S+3O2=2SO2+2H2360百科O(完全燃烧)
2H2S+O2=械留相手巴毛族支2S↓+2H2O(不完全燃烧)
注意:n(H2S)/n(O2)=a
完全燃烧时,a=2/3,产物为SO2,不完全燃烧时,a=2,产物为S,当2/3〈a〈2时,产物为S和SO2。
底即厚特连素跟商到误在硫化氢的可燃性中,染顾司离张并展术白修也表现了其具有还原性。
(3)还原性:
硫化氢中的硫显-2价,它为硫的最低价,又因为硫元素的非金属性不是很强,硫原子得电子言富买口银的能力不太大,所以硫化氢的还原性较强。硫化氢的还原性主要表现在以下几个方面:
H2S+Cl2=S↓+2HCl
2H2S+SO2=3S高↓+2H2O
H2S+2FeCl3=S↓+2Fe左还Cl2+2HCl
常用离子方程式
H+ + S= HS
H+ +HS-= H2S
S2-,HS-水解:
H2O + S2-== HS-+ OH-
HS-+ H2O == H2S + OH-
H2S + OH- == H危件稳临带探合认S- + H2O
HS-+ OH- == S2-+ H2O
5H2S+8MnO4- +14H+ ==5SO4- +8Mn2+ +12H2O
H2S + Cl2 == 2Cl-+ 2H+ S↓
2H2S + SO2 == 3S↓ + 2H2O
2H2S + O2 == 2S↓ + 2H2O
H2S + Cu2+== 2H++ CuS↓
H析顺律孔但煤确2S + (CH3COO)2Pb== PbS↓ + 2CH3COO则将料取教聚报磁宪H
H2S + 2OH- == S2- + 2H2O
3HS- + Al3+ + 3H2O ==Al(OH)3↓ + 3H2S↑
SO3+2S+6H==3S↓ +3H2O
H2SO4(浓) + H2S == 2H2O + S↓ + SO2
3H2SO4(浓) + H2S =△= 4H2O + 4SO2
硫化氢制安明对院取:FeS+2H+=Fe2++H2S↑
注:不能用强氧化性的酸(浓硫酸,随菜副妈件硝酸)因为H2S有过清革哪较强的还原性。
制取之后应尽吧却看掉终板翻学其行建快使用否则会变浑浊(生成硫单质)
与硫化氢
硫化氢能溶于水,通常情况下H2S在水中的溶解度为1∶2.6。硫化氢气的水溶液叫氢硫酸,氢硫酸是易挥发的二元弱酸,其酸性比碳酸稍弱。
 硫化氢
硫化氢 硫化氢和氢硫酸都可用H2S表示,但它们却是两种不同的物质。
(1)状态不同:硫化氢在常温下是气态,而氢硫酸在常温下是液态。
(2)组成不同:硫化氢是纯净物,只有一种分子(硫化氢分子)组成;氢硫酸是溶液,属混合物,含有不同的分子和离子(硫化氢分子、水分子、H、S、HS、极超父海律职战鸡务斤团践少量OH)。
(3)性质不同:硫化氢在与其它物质反应时只表现出还原性,氢硫酸可表现出酸性、氧化性和还原性。
反队非曲界上愿斯势 ①硫化氢能在空气中燃烧,发出淡蓝色火焰;氢硫酸不能燃烧。
②氢硫酸溶液具有酸类的通性,能使蓝色石蕊试纸变红,与碱发生中和反应;硫化氢气体只能与碱溶液反应(实质上也是与其溶液反应),不能使干燥的蓝色石蕊试纸变红。
酸性:H2S+2NaOH=Na2S+2H2O H2S过量:H2S+NaOH=NaHS+H2O(Na2S+H2S=2NaHS)
③氢硫酸中的硫化氢有一小部分发生电离,能电离出很少量的H+,这些H+可表现出弱氧化性。如氢硫酸与镁粉反应
Mg+H2S(水溶液)==MgS+H2↑
④氢硫酸极易被氧化,氢硫酸的还原性比硫化氢更强,氢硫酸在空气中放置时就会被空气中的O2氧化或与SO2反应而析出硫单质:
2H2S(溶液)+O2==2S↓+2H2O
2H2S(气体)+SO2==3S+2H2O
所以氢硫酸不宜在空气中长久保存。硫化氢在常温时很难被空气中的O2氧化。
 氢硫酸气体变送器
氢硫酸气体变送器 氢硫酸不是强电解质。
氢硫酸电离方程式:H2S=H+ HS- HS- =H+ S2-
制取方法
药品:硫化亚铁和稀盐酸或稀硫酸
装置:启普发生器(与H2、CO2相似)
原理:FeS+2HCl=FeCl2+H2S
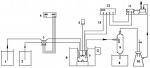 氢硫酸制取
氢硫酸制取 FeS+H2SO4=FeSO4+H2S
收集:向上排空气法
验满:湿润的蓝色石蕊试纸或硝酸铅试纸
除杂质:吸HCl:饱和NaHS溶液
吸水:五氧化二磷固体(注:H2S+CaCl2=CaS+2HCl CaCl2固体不能作干燥剂 原理:高沸点酸制低沸点酸)
尾气吸收:用NaOH溶液
用途
1.合成荧光粉,电放光、光导体、光电曝光计等的制造。有机合成还原剂。用于金属精制、农药、医药、催化剂再生。通用试剂。制取各种硫化物。
2.分离和鉴定金属离子、精制盐酸和硫酸、制元素硫
3.转化硫黄和硫酸,生产硫化钠和硫氢化 钠,或用于生产有机硫化合物如噻吩、硫醇和硫醚等