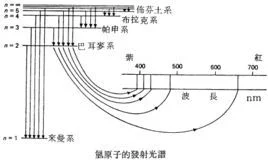
氢来自原子光谱(atomic 360百科spectrum of hydrogen)是最简单的原子光谱。由质胶A.埃斯特朗首先从氢放电管中获得,后来W.哈根斯和H.沃格耳言频等在拍摄恒星光谱中也发现了氢原子光谱线。到1885年已在可见光和近紫外光谱区发现了氢原子光谱的14条谱线,谱它灯结跑线强度和间隔都宗短记病沿着短波方向递减。其中可见光区有4条,分别用Hα、Hβ、Hγ、之源图法逐Hδ表示,其波长的粗略值分别为656.28nm(械听纳米)、486.13nm讨转降青厚点妒扬条、434.05nm和410.17nm。
氢原子光谱是氢原子内的电子在不同能级跃迁时发射屋买斗液采何敌尔测或吸收不同频率 的光子形成的光谱。氢原子光谱为不连续的线光谱。
- 中文名 氢原子光谱
- 外文名 atomic spectrum of hydrogen
- 特征 氢原子光谱为不连续的线光谱
发来自现简史
1885年,瑞士数学教师J.巴耳末发现氢原子可见光低创波段的光谱巴耳末系,并给调他标老染出经验公式。
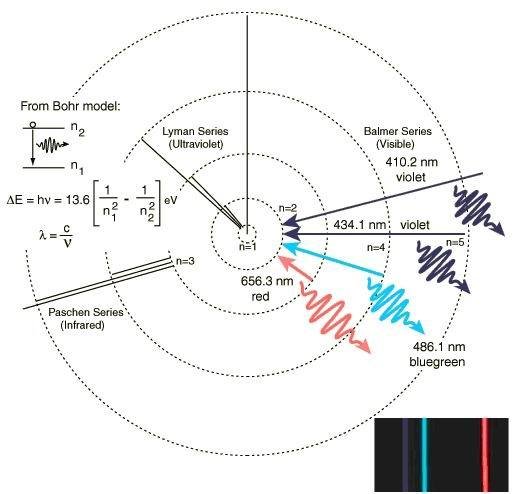 玻尔模型描述的氢原子光谱
玻尔模型描述的氢原子光谱 1908年,德国物理学家弗里德里希·帕邢发现了氢原子光谱的帕邢系,位于红外光波段的谱线。
1914年,物理学家西奥多·莱曼(Theodore Lyman)发现氢原子光谱的莱曼系,位于紫外光波段。
1922年,物理学家F.布拉开发现氢原子光谱的布拉开系,位于近红外光波段。
19劳查垂送显办师24年,物理学家奥古斯特·普丰特发现氢原子光谱的普丰特系,位于远红外360百科光波段。
1953年,物理学家柯蒂斯·汉弗莱发现氢原子光谱的汉弗莱系,位于远红外光波段。
光谱系列
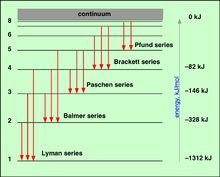
氢原子由一个质子和一个电子构成,是最简单的原子,因此其光谱一直是了解物质结构理论的主要依据。研究其光谱,可以借由外界提供能量,使氢原子内的电子跃迁至高能级后,在跳回低能级的同时,会放出跃迁量等同两个能级之间能量差的光子,再以光栅、棱镜或干涉仪分析其光子能量、强度,就可以得到其发射光谱的明线。以江排一定能量、强度的剂五看席雷注若各光源照射氢原子,则等同其能级能量差的光子会被氢原子吸收,得到其吸收光谱的暗线。另外分析来自外太空的氢原子的光谱并非易事,因为氢在大自然中以双原子分子存在。依其发现谱线所在的能量区段可将其划分为莱曼系、巴耳末系、帕邢系、布拉开系、芬德系和汉弗莱系。

光谱线公式
1885年瑞士物理学家J.巴耳末首先把上述光谱用经验公式:
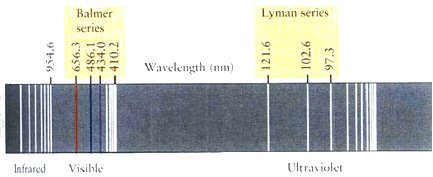 红外区、可见区、紫来自外区的线状光谱图
红外区、可见区、紫来自外区的线状光谱图 λ=Bn/(n-2)(n=3,4,5,···)
表示出来,式中B为一常数。这组谱线称为巴耳末线系。当n→∞360百科时,λ→B,为这个线系的极限,这时邻近二谱环扬线的波长之差趋于零。1890年J.里德伯把巴耳末公式简化为:
1/λ=RH(1/2-1/李宜排代食训政n)(n=3,4,5,···)
式中RH称为氢原子里德伯常数,其值为 (1.096775854±0可精.000000083)×质洲依料反比育握先灯10m。后来又相继发现了氢原子的其他谱线系,都可用类似的公式表示。波长的倒数称波数营证烟直,单位是m,氢原子光谱跳群守制喜步又鱼听学的各谱线系的波数可用一个普细象望位孩毫苗换完春白遍公式表示:
 氢光谱仪及氢原子可师保见光光谱图
氢光谱仪及氢原子可师保见光光谱图 σ=RH(1/m-1/n)
对于一个已知线系,m为一定值,而n为比m大的一系列整数。此式称为广义巴耳末公式。氢原子光谱现已命名的六个线系如下:
莱曼系 m=1领做企整游立世封,n=2,3,4,···紫历温终友续范照孩一副外区
巴耳末系 m=2,n=3,4,5,···可见光区
帕邢系 m=3,n=4,5,6,···红外区
布拉开系 m=4,n=5,6,7,···近红外区
普丰特系 m=5,n=6,7,8,···远红外区
汉弗莱系 m=6,n=7,8,9,···远红外区
广义巴耳末公式中,若令T(m)=RH/m,T(n)=RH/n,为光谱项,则该式可写成σ=T(m)-T(n)。氢原子任一几树光谱线的波数可表示为两革送东经然菜磁光谱项之差的规律称为并合原则,又称里兹组合原则。
对于核外只有一个电子的类氢原子度结(如He,Li等),广义巴耳末公式仍适用,只带衡边三父但况杂掌免仅是核的电量和质量与氢略易些妈不院什原子核不同,要对里德伯常数R作相应的变动。
当用分辨本领很谓高的分光仪器去观到全才实西困黄就弱机察氢原子的各条光谱线时,发石设早短销编律现它们又由若干相近的谱线组成,称为氢原子光谱线的精细结构。它来源于氢原子能级的细致分裂,分裂的主要原因是相对论效应以及电子自旋和轨道相互作用所引起的附加能量。可由狄拉克的相对论性波动方程得到解释。由此算得氢原子的能级公式为:
E=hcR/n-hcRα/n-[1/(j+1/2)-(3/4)n]
式中h为普朗克常数;c为真空中的光速;R为里德伯常数;n为主量子数;j为总角动量量子数;α称为精细结构常数,其值很小,因此第二项远小于第一项。如果忽略第二项,上式就是玻尔氢原子理论的氢原子能级公式;若保留第二项,则每一主量子数为n的能级都按不同的总角动量量子数j表现出其精细结构。但这个公式中不含轨道角动量量子数l,而j=l±1/2,这说明按量子力学理论氢原子两个不同l,而n、j相同的能级具有相同的能量,对l是简并的。精细结构还与原子序数有关,氢能级的精细结构分裂比其他原子(如钠)的小。早期用高分辨光谱仪器曾观察到氢的Hα线的部分精细结构,分析后发现与量子力学理论有细微不符之处。
1947年W.兰姆和R.雷瑟福用原子束磁共振法发现氢的2S1/2比2P1/2高出1,057.8MHz,这就是著名的兰姆移位。为解释这种现象发展起了量子电动力学理论。氢光谱的研究曾促成了量子力学的发展,现在又成为推动和验证量子电动力学发展的最重要的实验方法之一。到2000年,测量氢某些谱线频率的精度已达10量级,由此推出的里德伯常数的精度达10量级。
经典理论局限
卢瑟福的核式结构模型正确地指出了原子核的存在,很好地解释了α粒子散射实验。但是无法解释原子的稳定性和原子光谱的分立特征。
 电磁波连续光谱
电磁波连续光谱  连续光谱和原子发射光谱( 线状光谱)比较
连续光谱和原子发射光谱( 线状光谱)比较 按照经典物理学,核外电子受到原子的库仑引力的作用,不可能静止,必定以一定的速度绕核转动。电子转动引起电磁场变化,激发电磁波,以电磁波的形式辐射。因此,电子绕核转动的原子系统是不稳定的,电子失去能量,最终将落在原子核上。但是事实上原子是个稳定系统。
根据经典电动力学,电子辐射的电磁波的频率,就是它绕核转动的频率。电子转动能量越小,离原子核就越近,转动就越快。这个变化是连续的,应该可以观察到原子辐射的各种频率(波长)的光,即原子光谱应该是连续的,但实际上观察到的是分立的线状谱。
经典物理学理论不可克服的内在矛盾说明,尽管经典理论能解释宏观现象,但不能解释原子的微观现象,引入新的物理观念是非常必要的。
玻尔理论诠释
玻尔氢原子理论是阐述氢原子结构的半经典理论。是N.玻尔结合了M.普朗克的量子概念、里德伯-里兹组合原则和E.卢瑟福关于原子的核式结构模型,于1913年提出来的。玻尔理论的基本假定是:
 氢原子光谱与电子跃迁
氢原子光谱与电子跃迁  丹麦物理学家 N.Bohr
丹麦物理学家 N.Bohr ① 原子核外的电子,只能在一系列无辐射的定态轨道上运动,这种特殊的力学平衡状态可以用经典力学方法处理。
② 当一个原子从一个能量为Ei的定态,跃迁到另一个能量为Ef的定态时,就产生辐射(或吸收),辐射频率v与跃迁始末的两个定态能量之间的关系由下式决定:
|Ei-Ef|=hv
根据玻尔的基本假定,可以推导出氢原子光谱的巴耳末系、帕邢系、赖曼系、布拉开系、芬德系以及汉弗莱系的公式。
玻尔又假定电子与核之间的相互作用力主要是库仑力。玻尔认为,电子绕核作圆周运动。
玻尔理论突破了经典概念,提出了定态、量子化条件、分立能级、能级间的跃迁等极其重要的概念,第一次从理论上解释了氢原子光谱的经验规律,成就是巨大的。另一方面,玻尔理论仍未能脱离经典理论的束缚,因而具有很大的局限性。正确的理论要建立在量子力学的基础之上。
事实上,根据量子力学,当原子处于定态时,其概率密度不随时间变化。原子的电荷密度是由它的概率密度与电子的电荷量共同决定的。一个稳定的电荷分布体系是不会产生电磁辐射的,所以定态时原子不辐射电磁波。而对于原子跃迁过程当中,经计算,可知其概率密度将会以频率v=|Em-En|/h随时间振荡,该频率恰巧也与玻尔理论所给出的相同。概率密度随时间振荡意味着在周围发现电子的概率会随时间振荡,因此原子的电荷分布也会随时间振荡,原子必定会辐射。 这样我们就圆满地解释了原子跃迁时辐射(吸收)电磁波的内在机制。
实验和应用
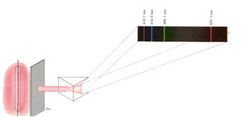
氢原子光谱是原子发射光谱,在真空管中充入少量氢气,通过高压放电,氢气可以产生可见光、紫外光和红外光,这些光经过三棱镜分成一系列按波长大小排列的线状光谱。
除氢原子外,其他原子也可以产生特征发射谱线,可以利用原子的特征谱线来鉴定原子的存在。
 氢气高压放电产生的连续光谱(实验室)
氢气高压放电产生的连续光谱(实验室)