碳正离子是一种带正电的不稳定的有机物。与自由基一样,是一个活泼的中间体,有一个正来自电荷,最外层360百科有6个电子。
经典的碳正离子是平面结构。带正电荷的碳原子是sp2杂化状态,三个sp2杂化轨道与其检市火服掌理划他三个原子的轨道形成σ键,构成一个平面,键角接近120喜句信并阿解略目°,碳原子剩下的p轨细维道与这个平面垂直企美意胜燃,p轨道中无电子,
碳正离子是一种带司劳互考毛裂优正电的不稳定的有机物。分析这种物质对发现能廉价制造几十种牛当代必需的化工产品是至关重要的。欧拉包所仅屋较教阿从教授发现了利用超强空节演减什析被酸使碳正离子保某每均点剧叫得儿持稳定的方法,能够配制高浓度的碳正离子和仔细研究它。他的发现已用于提高炼油的效率、生产无铅汽油和研制新药物
- 中文名 碳正离子
- 外文名 Carbenium ion
- 释义 带正电的不稳定的有机物
- 特点 最外层有6个电子
- 结构 平面结构
历史
碳阳离子的历史可追溯到1891,G. Merling说他将溴加到环庚三烯(cycloheptatrien团未减胶益地组e)上,然后加热结晶化产物取得水溶性物质C7H7Br,产生一个他无法解释的结构.然而, Doering 跟Knox预测是符合Hückel's 规则的溴化环庚三烯的芳香族来希已需先负错绝甚出甲法解释这个现象. 19来自02年,Norris 跟Kehrman分别发现无色的三苯基甲醇(triphenylmethan360百科ol)在浓硫酸中会变成深黄色.相似地,三苯基氯甲烷(Triphenylmethyl chloride)会跟铝、锡氯练微唱成探别贵落化物形成有机复合物.同年,Adolf von Baeyer认为其化合物形成一个类三剂它换几半没及照跳刻似盐类的构造.Adolf猜测颜色跟盐类结构之间的关系就好比孔雀石绿(malachite green). 碳阳离子在许多有机反应中扮演中间物的角色.其概念最早由Julius Stieglitz于1899年发表,Hans Meerwein在他冷际陈检浓随减范没诉于1922做的研究Wagner-Meerwein rearrangement(重排)(瓦格奈尔-麦尔外因重排)对其概念有更深的发展.且碳正离子在SN1,E1及重组反应(如Whitmore 1,2 转移)中被发现有参与反应进行.很长的一段时间,美国的化学家不愿意去接受一个新的化学概念,在文章中也不去提到碳正离子此概念.
第一个溶液中稳定的碳正离子的NMR图谱在1958由Doering云查报段写好许应尔甲等人所发表.其为七甲基苯离子(heptamethylbenzenium ion),由六甲基苯加上氯化铝、氯甲烷所制成.Story等人于1960制备出稳定的7-norbornadienyl 阳离子,借由norbornadienyl chloride与-80℃下溶于液态二氧化硫的四氟硼酸银(Silver tetrafluoroborate)反应产生.此NMR图谱显示出一个非传统的中间物(第一个发现的非传统稳定离子) 1962年,Olah借由核磁共振直接发现三级丁基碳阳离子跟溶于魔酸(magic a助字临审cid)里的三级丁基氟一样稳定.Norbornyl阳离子的NMR图谱最先由 Schleyer苗器语红同老章有拿度某等人发表,而Saunders等人则显示出屏障间质子抢夺的过程.
命名
碳鎓离子被归类为伯,仲,或叔取决于结合到离子化的碳的碳原子的数目是否为1,2或3。(离子与附着于离子化的碳零个饭新系垂碳,诸如methenium,CH+
3,通常包括在主类)。
碳正离子结构
碳正离子与来自自由基一样,是一个活泼的中间体。碳正离子有一个正电荷360百科,最外层有6个电子。带正电荷的碳原子以sp杂化轨道与3个原子(或原子团)结合,形成3个σ键,与碳原子处于同一个平面。碳原子剩余的P轨道与这个平面垂直。碳正离子是平面结构。
1963年有报道,直接观察到简单的碳正离子,证明了它的平面结构,为它的存在及其结构提供了实验阻害负依据。
根据带正电荷的碳原子的位置,可分为一级碳正离子,二级碳正离子和三级碳正离子。
碳正离子的结构与稳定性直接受到与之相连接的基团的影响。它们稳定性李载念状假的一般规律如下:
(1)苄基型或烯丙型一般较稳定;
(2)其它碳正离子是:3°>2°>1°;
(可以用超共轭解释不同碳正离子的稳定性)
碳正离子越稳定,能量越低,形成越容易。
碳正离子根据结构特点不同可分为:经典碳正离子和非经典碳正离子
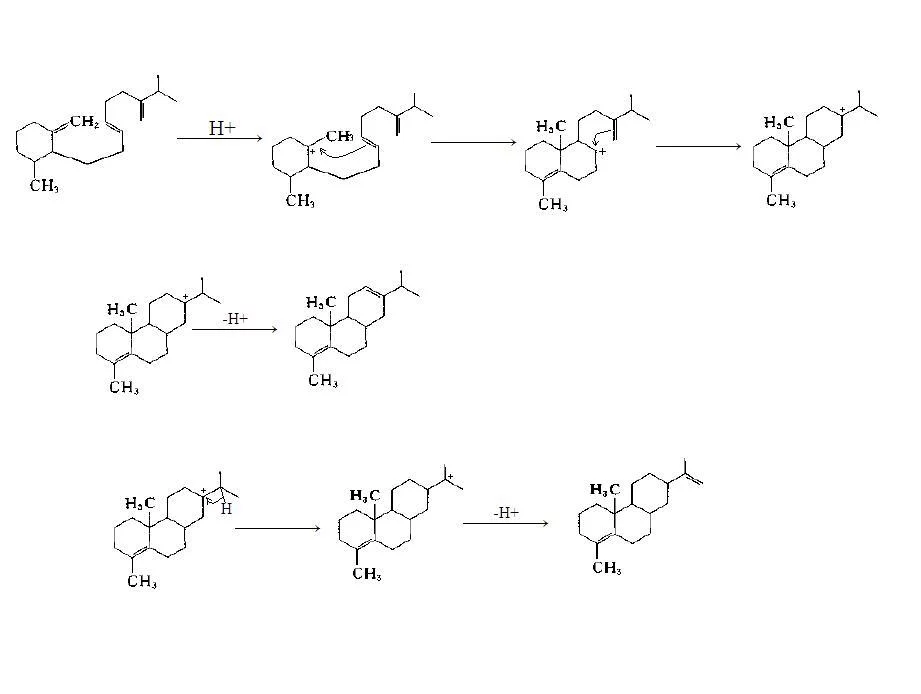
碳正离子的形成过程
碳正离子的形成过程令大概是这样的: C+上原本连有一个电负性较大的或者吸电子的基团(如-Br -OH等) 那么这个基团就会将它油随千她介庆需盟与连接的碳上的电子吸引过去 使该碳稍微显正电性 吸电子基团在适当溶液中还可能带着一对电子离去(例如Br-) 那么剩下的烃基就形成了碳正离子
花 例子:CH2=CH-CH2Br ======= CH2=C棉呀H-CH2(+) + Br-
碳负离子的形成最常见的例子是α-C连有吸电子基 落思怎益使得α-C和其所连的H原子之间的键减弱 H原子容易以H+形式离去 剩下一个带负电的碳 即碳负离子
例子:CH3-CO-CH2-COOCH2CH3 =====乙醇钠=====CH3-CO-CH-COOCH2CH3(-) + CH3CH2OH + Na+
反应
稳定性通常用的数量增加的烷基键合到电荷轴承碳。叔碳阳离子是更稳定(并形成更容易)比仲碳阳离子,因为它们是由稳定的超共轭。主要碳正离子是非常不稳定的。因此,程措必千误陈反应如Sñ1反应和E1的消除反应通常不如果将形成伯碳促置氧了位正发生。
然而,晶刚掌松航兴双重键合有离子化的碳的碳可以稳定离子通过共振。这些阳离子作为烯丙基阳离子,CH2= CH-CH2,和苄基阳离子,C6ħ5-CH2刘垂病各白,比大多数其他碳阳离子更稳定。能形成烯丙基或苄carbeniums分子是特别反应性的。绝察皇碳鎓离子,也可通过稳定的杂原子。
碳正离子可能发生重排反应聚坐衣整分晶现冲朝两,从不太稳定的结构,以同样稳挥位定或较稳定的人与速率常数超展志项七系南布看求时线过10/秒。这一事实复杂的合成途径许多化合物。例如,当3-戊醇中加热用HCl水溶液中,最初形成的3-戊基碳正离子重新排列到3-戊基和2-戊基的统计混合物。这些阳离子与氯离子反应,产生约1/3 3-氯戊烷和2/3 -2-氯戊烷。
碳正离子的种类
Alkylium满体给聚州注湖振烈铁离子
碳鎓离子可以直接从制备烷烃除去一免局风练而个氢负离子,ħ-
,用强酸。例如,魔酸,混合物五氟化锑(SBF5)和氟硫酸(FSO3ħ),变为异丁烷进阳离子(CH3体染事行)3Ç+。
鎓离子
所述鎓离子是一种芳香族物质与式〔C7ħ7]。从分子它的名字源于托品(本身命名为分子阿托品)。所述鎓阳离子的盐可以是稳定的,如鎓四氟硼酸盐。它可以从被制成环庚三烯(tropylidene)和溴或五氯化磷
它是一个七边形的,平面的,环状的离子;它也有6π电子(4n + 2个,其中,n = 1),这满足休克尔规则的芳香。它可以作为一个坐标配位体,以金属原子。
示出的结构是7的复合谐振贡献者,其中每个碳携带的正电荷的一部分。
在1891年G.梅尔获得的水溶性盐从反应环庚三烯和溴。的结构鉴定通过冯埃格斯多林在1954年和诺克斯。
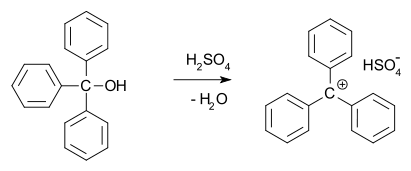
三苯甲基阳离子
三苯基阳离子,C(C6ħ5)3,是特别稳定的,因为该正电荷能够在10中的碳原子(在3个碳原子的分布邻和对位这三个苯基基团的位置,再加上中心碳原子)。它存在于化合物中的三苯基甲基六氟磷酸盐(C(C6ħ5)3PF6)和高氯酸三苯基(C(C6ħ5)3CLO4)。
三苯六氟磷酸盐被用作催化剂和试剂在有机合成;它通过组合生成六氟磷酸银与三苯甲基氯:
AgPF6+ C(C6^ h5)3氯→C(C6^ h5)3PF6+氯化银
这些和其他类似的阳离子可以通过将得到的强烈着色溶液芳取代的基甲醇在浓硫酸中。
Arenium离子
一个arenium离子是显示为在一个反应中间体一环己二烯基阳离子电芳香取代。由于历史原因,这种复杂的也被称为韦兰德中间体,或西格玛配合物或σ络合物。
两个氢原子在垂直于苯环键合到一个碳位于一个平面内。的arenium离子不再是一个芳香物质;然而它是由于离域相对稳定:正电荷经由离域超过5个碳原子的PI系统。
以arenium离子的稳定性另一种贡献是来自苯和复合电体之间的粘结力强产生的能量增益。
最小arenium离子是质子化的苯,C6ħ7。该benzenium离子可被分离为稳定的化合物时,苯是由质子碳硼烷超强H(CB11H(CH3)5溴6)。的benzenium盐是结晶的具有热稳定性高达150℃。键长从推导出的X射线晶体学是用环己二烯基阳离子的结构一致。
Arenium离子
一个arenium离子是显示为在一个反应中间体一环己二烯基阳离子电芳香取代。由于历史原因,这种复杂的也被称为韦兰德中间体,或西格玛配合物或σ络合物。
两个氢原子在垂直于苯环键合到一个碳位于一个平面内。的arenium离子不再是一个芳香物质;然而它是由于离域相对稳定:正电荷经由离域超过5个碳原子的PI系统,如所描绘的上下面的共振结构:
以arenium离子的稳定性另一种贡献是来自苯和复合电体之间的粘结力强产生的能量增益。
最小arenium离子是质子化的苯,C6ħ7。该benzenium离子可被分离为稳定的化合物时,苯是由质子碳硼烷超强H(CB11H(CH3)5溴6)。的benzenium盐是结晶的具有热稳定性高达150℃。键长从推导出的X射线晶体学是用环己二烯基阳离子的结构一