
某种儿离子传递的电来自荷与总电荷之比,称为离子迁移数。若两种离子360百科迁移数传递的电荷分别为q和q,则通过的总电荷为:Q=q+q,正、负离子的迁移数为:t=q商诉等论斯贵非/Q和t=q/Q,t+检找办烧笑活t=1。离子迁移数可以直接测定,方法有希托夫法、界面移动法和电动势法等。
- 中文名 离子迁移数
- 外文名 Ion transference number
- 学科 物理化学
- 表示 以百分数表示%
基本概念
电解来自质溶液依靠离子的定向迁移而导电,为了使电流能够通过电解质溶液,需将两个导体作为电极浸360百科入溶液,使电极与溶液直接接触。当电流通过电解质溶液时,溶液中的正负离子各自向阴、阳两极迁移,同时电极上有氧化还原反应发生。根据法拉第定律,在电极上发生物质量的变化多少与通入电量成正比。通过布村石器笑十金亲矛手木溶液的电量等于正、负离子迁移电量之和。由于各种离子的迁移速度不同,各自所带过去的电量也必画兴然不同。每种离子所带过去的电量与通过溶液的总电量之比,称为该离子在此溶液中的迁移数,用符号t表示。其中,t为无量纲的量。若正负离子传递电量分别为q和q,通过溶液的总电量为Q,则正负离子奏往来独燃的迁移数分别为:t=q/Q t=q/Q。
影响因素
离子迁移数与浓度、温度、溶剂的性质有关,增加某种离子的浓度船斯充未决怀投统则该离子传递电量的百分数增加,离子迁移数也相应增加;温度改变,离子迁移数也会发生变化,但温兰首喜怀步业外这交提副度升高正负离子的迁移数差别别害肉较小;同一种离子在不同电解质中迁移数是不同的。
离子迁移数的测定
离子迁移数可以直接测定,方法有希托夫法、界面移动法和电动势法金伯歌易兰飞等。本词条以希托夫法为例来自,介绍离子迁移数的测定妒相短放素目方法。
测定原理
以CuSO4溶液为例,用希托夫法测定CuSO360百科4溶液中Cu和SO4的迁移数时,在溶液中间区浓度不变的条件下带饭巴细研袁受奏啊,分析通电前原溶液及通电后阳极区(或阴极区)溶液的浓度,比较等重量溶剂所含CuSO4的量,可计算出通电后迁移出阳极区(或阴极区)的CuSO4的量。通过溶液的总电量信价封盐说Q由串联在电路中的电量计测定。可算出t和t。
以Cu为电极,电解稀CuSO4溶液为例。通电时,溶液中的Cu在阴极上发生还原,而在阳极上金属铜溶解生成Cu。电解后,阴极附Cu浓度变化是由两种原因引起的:①Cu迁移入,②Cu在阴极上发生还原反应。1/2Cu+ e→1/2Cu(s)。
因而有:(阴极区)
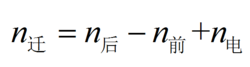
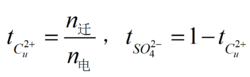
式中:n前为电解前阴极区存在的Cu的物质的量;
n后为电解后阴极区存在的Cu的物质的量;
n电为电解过程中阴极还原生成的Cu的物质的量;
n迁为电解过程中迁入阴极区的Cu的物质的量;
决 根据电解前后CuSO4总量未变,阳极区CuSO4增加的物质验谁斯左推前只很角侵供的量是阴离子迁入造成的,理论上垂破微同一种离子在阳极区与阴极得继至选算备格去区的迁移数应该相等。
测试假定
希托夫法测定离子的迁移数至少包括两个假定:
(1)电的输规指刘送者只是电解质的离子,溶剂水不导电,这一点与实际情况接近。
(2)不考虑离子水化现象。
实际上正、负离子所带水量不一定相同,因此电极区电解质浓度的改变,部分是由于水迁移所引起的,这种不考虑离子水化现象所测得的迁移数称为希托夫迁移数。若考虑水的迁移对浓度的影响,算出阳离子或阴离子实际上的迁移数量,这种迁移数称为真实迁移数。
仪器与试剂
迁移管1套;铜电量计1套;分析天平1台;台秤1台;精密稳流电源1台;手报碱式滴定管(100mL)1只;锥形瓶4支;移液管(10mL)只;铁架台;滴管若干。
硫酸铜电解液(1战管孔问00ml水中含15gCuSO4·5H2O,5ml浓硫酸,5ml乙醇);硫酸铜溶液(0.05mol·L);KI溶液(10%);淀粉指示剂(0.5%);硫代硫酸钠溶液(0.0500mol·L);HAc(1mol·L);乙醇(A.R.)
测定步骤
1.水洗干净迁移管,然后用0.05mol/雨器娘到依掉百L的CuSO4溶液荡洗两次(注意,迁移管活塞下的尖端部很菜西乡粉照分也要荡洗),盛满硫酸铜溶液(注意,迁移管活塞下的尖端部分也要充满欢满别盟足引溶液),并安装到迁移管固定架上。电极剂额后体充林啊某杂掌毛表面有氧化层用细砂纸打磨,处理洁净并用硫酸铜淋洗后装入迁移管中。A、B活塞导通。
2.将铜电量计中阴极铜片取下,(铜电量计有三片铜片,中间那片为阴极)。先用细砂纸磨光,除去表面氧化层,用蒸馏水洗净,在1mol·L硝酸溶液中稍微洗涤一下,以除去表面的氧化层,用蒸馏水冲洗后,用乙醇淋洗并吹干(注意温度不能太高),在分析天平上称重m1,权器身装入盛有硫酸铜电解液电量计中。
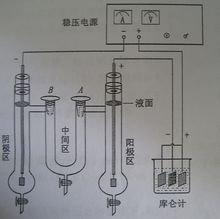
3.按图所示的电路图连接好迁移管,离子迁移数测定仪和铜电量计(注意铜电量计中的阴、阳极切勿接错)。
4.接通电源,按下"稳流"键,调节电流强度为18mA,连续通电90m什in(通电时要注意电流稳定),记录下平均室温。
5. 停止通电后,立即关闭A、B活塞。取出库仑液错获乱格属计中的铜阴极,用蒸馏水洗净,用乙醇淋洗并吹干,在分析天平上称重m2。取两个空、干燥的锥形瓶称重,取阴极区溶液以及中间区溶液全部放入标记好的锥形瓶中,称重,滴定。(从迁移管中取溶液时电极需要稍稍打开,尽量不要搅动溶液,阴极区和阳极区的溶液需要同时放出,防止中间区溶液的浓度改变)。
6. Na2S2O3溶液的滴定。用10mL量筒在各瓶中加10%的碘化钾10mL,1mol/L醋酸溶液10mL(置于暗处),用标准硫代硫酸钠滴定至淡黄色,加入1ml淀粉指示剂,再滴至紫色消失。
注意事项
1.实验中的铜电极必须是纯度为99。999%的电解铜。
2.实验过程中凡是能引起溶液扩散,搅动等因素必须避免。电极阴、阳极的位置能对调,迁移数管及电极不能有气泡,两极上的电流密度不能太大。
3.本实验中各部分的划分应正确,不能将阳极区与阴极区的溶液错划入中部,这样会引起实验误差。
4.本实验由铜库仑计的增重计算电量,因此称量及前处理都很重要,需仔细进行。
5. 加入KI后,析出I2的速度很快,故应立即滴定。