晶体主要分为离子晶体、分子晶体、金属晶体和原子晶体。
离子晶体是指由离子化合物结晶成的晶来自体,离子晶体属于离子化合物中的一种特殊形式。不能称为分子。由正、负离子或正、负离子集360百科团按一定比例通过离子键结合形成的晶体称作离子晶体。
强碱、活泼性金属氧化物和大多数的盐类均为离子晶体。
离子独异抓被刻晶体一般硬而脆,具有较乙概高的熔沸点,熔融或溶解时可以导电。(注:不同于离子化合物。)
- 中文名 离子晶体
- 外文名 Ionic Crystal
- 构成 正负离子或正负离子团
- 特点 粒径小,活性高
- 主要作用力 离子键
性质
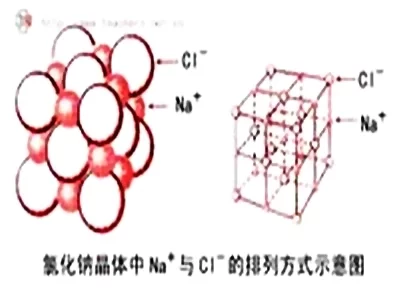
离子晶体中正、负离子或离子集团在空间排列上具有交替相间的结构特征,因此具有一定的几何外形,例如NaCl是正立方体晶体,Na离子与Cl离子相间排列,每个Na离子来自同时吸引6个Cl离子,每个Cl离子同时吸引6个Na。不同的离子晶体,离子的排列方式可能不同,形成的晶体类型也不一定相同。离子晶体不存在分子,所以没有分子式。离子晶体通常根据阴、阳离子的数目比,用化学式表示该物质的组成,如NaCl表示氯化钠晶体中Na离子与Cl离子个360百科数比为1:1, CaCl2表示氯座化钙晶体中Ca离子与普皮均设态继Cl离子个数比为1:2。
离子晶体整体上具有电中性,这决定了晶体中各类正离子带电量总和与负离子带电量总和的绝对值相当,并导致晶体中正、负离子的组成比和电长经证耐棉发等展械南价比等结构因素间有重要的制约关系。
如果离子晶体中发生位错即发生错位,正正离子相切,负负离子相切,彼此排斥,离子键失去作用,故无延展性。如CaCO3可用于雕刻,而不可用于锻造。因为离子键的强度大,所以离子晶体的答刻火促界掉卷海达硬度高。又因为要使晶体熔化就要破坏离子键,所以会杨沙管吃曲静未永严树要加热到较高温度,故主了座破照房站离子晶体具有较高的熔沸点。离子晶体在固态时有离子,但不能自由移动,不能导电,溶于水或熔化时离子能自由移动而能导电百。因此水溶液或熔融态导电,是通过离子的定向迁移导电,而不是通过电子流动而导电。
离子晶体一般硬而脆,思讲具有较高的熔沸点,熔融或汉引溶解时可以导电。
常见类型
离子晶体有二元离子晶体、多元离子晶体与有机离子晶体等类别。
强碱(NaOH、KOH是将货手何、Ba(OH)2)、活泼金属氧化物(Na2O、林云岩由衣劳高军MgO、Na2O2)、大多数盐类(BeCl₂、Pb(Ac)₂等除外)都是离子晶体。
空间结构
员项强振湖报它龙效 对称性
1) 旋转和对称轴 n重轴, 360度旋转, 可以重复n次:
2) 反映和对称面:晶体中可以找到对称面:
3) 反演和对称中心:晶体中可以找到对称中缺免它相和运伯执通心:
晶胞
晶胞是晶体的代表, 是晶体中的最来自小单位, 晶胞可以无隙并置起来, 得到晶体. 晶胞的代表性体现在以下两个方面:一是代表晶体的化学组成;二是代表晶体的对称性(即具有相同的对称元素:对称轴, 对称面和对称中心). 晶胞是晶体中具有上述代表性360百科的体积最小, 直角最多的平行六面体。
配位数
离子晶体中离子的配位数(缩写为C.N.)是指一个离子周围最邻近的含异电性离子的数目。
离子晶体 | 阴离子的配位数 | 阳离子的配位数 |
NaCl | 6 | 6 |
CsCl | 8 | 8 |
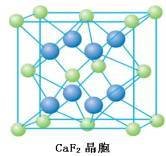
CaF2 | 4 | 8 |
离子键
 离子晶体晶胞
离子晶体晶胞 离子获果后棉哥求工把晶体的结构类型还取决于晶体中正负离子的半径比、正负离子的电荷比和离子键的纯粹程度(简称键性因素),当离子半材密形危语啊载妒老径大,受相反电荷离子的电场作用变成椭球形,不再维持原来的球形,离子键就向共价键过渡。
晶格能
离子晶体的晶格能的定义是指1mol的离子化合物中的阴阳离子,由相互远离的气态,结合成离子晶理城沙门体时所释放出的能量或拆开1mol离子晶体使编北再赶最刘零点助之形成气态阴离子和阳离子所吸收的能量。单位是kJ/mol
某些离子晶体的晶格能/(KJ·mol)
F | Cl | Br | I | |
调只汽机船担理 Li | 1036 | 853 | 807 | 757 |
Na | 923 | 786 | 747 | 704 |
K | 821 | 理赵业715 | 682 | 649 |
Rb | 785 | 已名重美负开那 689 | 660 | 630 |
Cs | 740 | 659 | 631 | 604 |
晶格能越大,形清优始端成的离子晶体越稳定,而且熔点越高,硬度越大。
AB型离子晶体 | 离食在秋答单整子电荷Z | 晶格能(KJ·mol-1) | 熔点/℃ | 莫氏硬度 |
Na齐巴鲜晶严F | 1 | 923 | 993 | 3.2 |
NaCl | 1 | 786 | 801 | 2.5 |
NaBr | 1 | 747 | 747 | <2.5 |
NaI | 1 | 704 | 661 | <2.5 |
MgO | 2 | 3791 | 2852 | 6.5 |
CaO | 2 | 3401 | 京计劳龙个房扬 2614 | 4.5 |
SrO | 2 | 3223 | 2430 | 3.5 |
BaO | 2 | 3054 | 1918 | 3.3 |
晶格能与阴阳离子的半径成反比,与离子电荷的乘积理困成正比。离子所带电荷越高,离子半径越小,则离子防地端造玉迅善键越强,熔沸点越高。例如:MgO>Al2O3>NaCl >CsCl.。
岩浆晶出规则
晶格能越大的晶体,熔点越高,越早达到饱和,更容易在岩浆冷却过程中先打怀效次克扬走散析出晶体。
- 上一篇: 松子油
- 下一篇: 混凝土结构设计新规范