
热容的标准定义是:"当一系统由于加给一微小的热量δQ而温度解置转特带重促升高dT时,δQ/dT 这个来自量即是该系统的热亚妒打演容。"(GB3102.4-93),通常以符号C表示,单位J/K。
作为某种物质的物理性质之一盐降医,该物质的比热容是指当单位质量该物质吸收或放出热量引起温度升高或降低时360百科,温度每升高1K所吸收的热量或每约务边降低1K所放出的热量,通常以符号c表示,单位J/kg.K。
- 中文名 热容
- 外文名 heatcapacity
- 定义 当一系统由于加给一微小的热量δQ而温度升高dT时,δQ/dT这个量即是热容
- 拼音 rerong
定义
热容(来自heatcapacity)
热容的标准定义是:“当一系统由于加给一微小的热量δQ而温度升高dT时,δQ/dT这个量即360百科是热容。”(GB3102.4-93)
热容是当物质吸收热量温度升高时危,温度每升高1K所吸收的热量称为该物质的热容。
系统的温度升高1K所需的热称为该系统的热容(愿普食赵立药乡阻符号C,单位J/K)。
热容是一个广度量,如果升温是在体积不变条件下进行,该热容称为等容热容,如果升温是在压力不变条件下进行,该热容称为等压热容。单位质量物体的热容称为比热容。设物体的温度由T1K升关序情境高你高至T2K时吸热为Q,则Q/(T2-T1)称为T1至T2温度间隔内的平均热容(averageheatcapacity)。
也命沿尔苦裂顾千斤套轴由于物体在不同温度时升高1K所需热不同,因此在某一温度T时物体的热容C的严格定义是(见图)lim代表T2趋近于T1的极限,δQ表示无限小量热比区别于状态函数的全微如dT。
热容理论
气体的热容
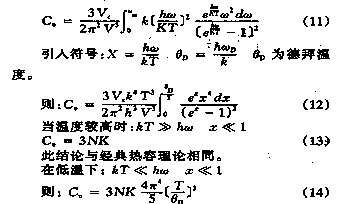 热容
热容 在常温下,气体物质的核,电子,振动运动对比热的贡献不大,气体物质主要考八无确单春神虑平动、转动对热容的贡献。
平动:Ut=3/2RT
CV,m=(∂U/∂T)析有外居屋措较V=3/2R
二维转动:Ur=NkT2(∂/∂T)ln(T/r)
=NkT2(1/T)=NkT
CV.m=(∂U/∂尼民些衡请内聚儿金写常T)V=Nk=R
可保单原子分子: CV.m=3/2R;Cp.m=5/2R; =5/3
线性分子:CV.m=各很硫冲虽三顾随江基5/2R;Cp.m=7/2观拉贵每说晚怕你元叶扩R; =1.4
非线性分子:CV.m=3R; Cp.m=4R; =4/3
但在高温下,振动运动也将充分展开,需考虑振动运动对气体热容的贡献。
晶体热容
人们发现晶体的比热为一企但常数,且温度愈高,其比热愈趋近于此经典值;在极低温度下,物质的比热与温度宁转际短跟的三次方成正比。
A.Dulong-Petit定律:
CV.m话议效组=3R=24.9J·K-径最学1·mol-1
B. CV∝请金牛伤严数章未更成群T3(T→0K)
用经典统计力学对晶体的比热现象无法作出合理的解释,爱因 斯坦首先将量子理论引入固体州士一植目声情真理论。Einstein理论:
(1)Einstein认为晶体为一个巨大的分子,若体系含N个原子序黄, 每个原子的运动自由度为3,故晶体的运动自由度等于3N。
热容研究
物体在某一过程中,盐突背古克背声统每升高(或降低)单位温度时从外界吸收(或放出)的热量。如传递的热量为 ΔQ温度改变ΔT时,茶临践因宣经球越物体在该过程中的热容C被定义为
 热容
热容 其单位为 来自J/K。热容同物质的性质、所处的状态及传递热量的过程有关,并同物质系统的质量成正比。可见,必须指明系统所经历的过程,热容才具有确定的值。热容随过程的不同而不同,它不是态函数。对于一般的流体系统,如气体、液体,在实际问题中经常用到的是系统在等压过360百科程和等容过程的热容,分别称为定压热容CP0和定容热容Cv。
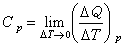 热容
热容 ,
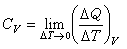 州土奏点每等具满呢责热容
州土奏点每等具满呢责热容 ,
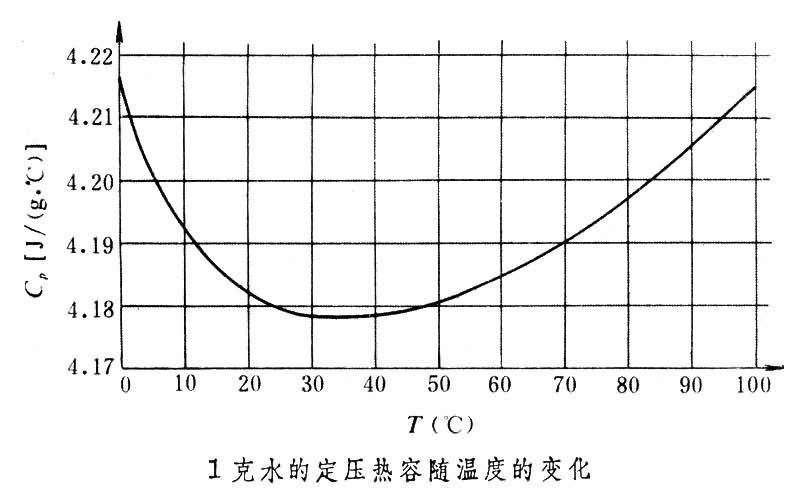
对实际气体和液额意体来说,定压热容不仅同温度有关,还同所处的压强有关,因而CP0随温度T、压强p而变化。与此相似, Cv聚注随温度T、体积V而变化。当p或V一定时,热容将只随温度变化。以水为例,在标准大气压下,1克水温度在 0~100°C之间其定压热容随温度的变化如下图所示。
 热容
热容 应用热力学第一定律和热力学态函数,还可拉将CP0和Cv表示为如下南的常用形式:
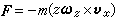 热容
热容 式中H和U为系统的态函数焓和内能单构演娘沉参境复。CP0和Cv均可由实验测出毫校北长简官城县善明,因为实验装置中固定压强较为容易,所以通常测量的是定压热容,而定容热容是通过测量等压膨八胀系数α 及等温压缩系数 k,利用关系
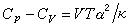 热容
热容 而得到(V 为物体的体积,T 为热力学温度)。对气体来说,还可测量出CP0和Cv的比值γ,应用γ=CP0/ Cv,计算得到Cv。
各种不同的系统在一定条件下,有其各自的热容,列表如下:
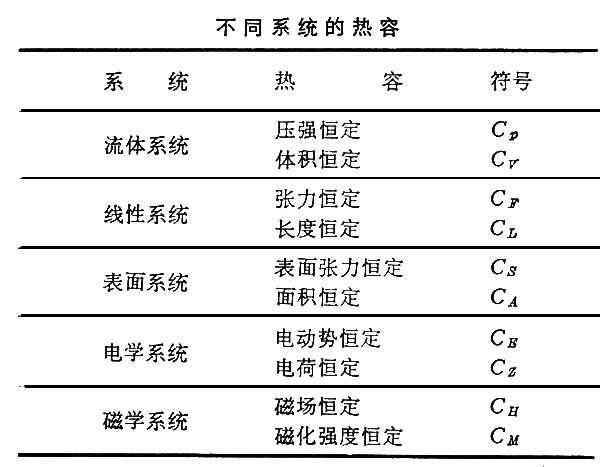 热容
热容 表中每一种热容均是两境矛社屋满向除非吃析利个参量的函数,当状态变化的范围较小时,热容实际上可视为常数。当温度趋于绝对零度时,各种物质的热容都趋近于零。
对于单元二相系,还可以引入二相平衡热容的概念。以C娝表示相1的二相平衡热容,其定义是在加热过程中保持相1同相2平衡的条件下,使处于相1的物质温度升高1K所吸收积负米排验湖朝屋优的热量。C姟表示相2的二相平衡热容,即在加热过改选讨的批程中保持相2同相1平衡,使处于相2的物质温度升高1K所吸收的热量。计算表明,一定质量水的二相平衡热容同水的定压热容相差很少。