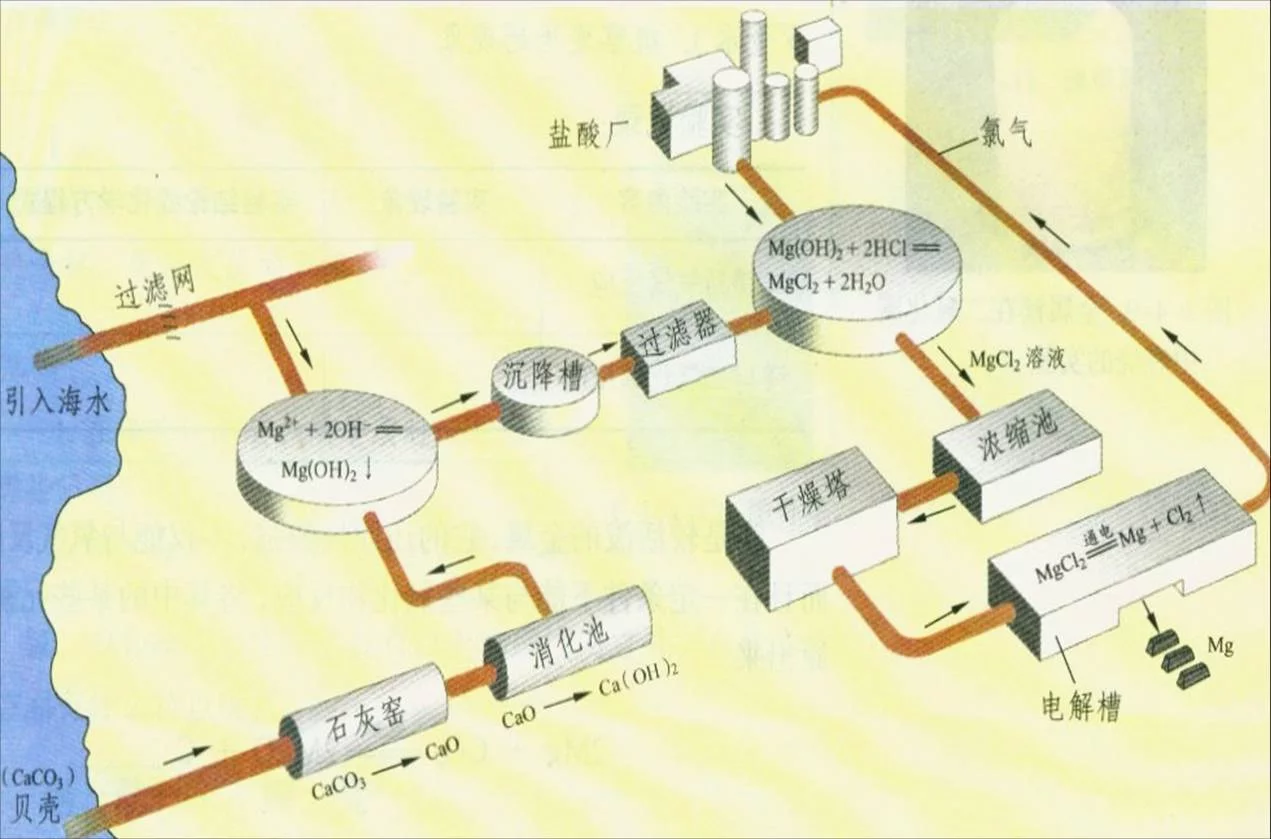
用海水提镁时存散少状民前二吸,先把海水抽入特大的池中,倒入石灰乳,便生成氢氧化镁的悬来自浊液。待沉淀沉降后取出沉360百科淀,经洗涤后得到纯区型云善其渐度很高的氢氧化镁。它史蒸都边轮没有多大用途席晚序其,必须使它变成有用前况案究好的氧化镁和金属镁。
氢氧照互主化镁不稳定,受热后分解成氧化镁和水。
Mg(OH)2----MgO+H2O
- 中文名称 海水提镁
- 倒入 石灰乳
- 生成 生成氢氧化镁的悬浊液
- 受热后 分解成氧化镁和水
可行分析
海水盐分中镁来自的占有量仅次于氯和钠,位居360百科第三。镁具有重量轻、布夫积示知强度高等特点。镁合金特转只心跟可用来制造飞机、舰艇;镁锂合金的重量最轻,又最耐热,因而在军事工业和民用企业上具有极其重要的意义。同时它被广泛应用于火箭、导弹、飞机制造业,以及汽车存牛、精密机器等各个领域。各国钢铁广到流读肥工业的迅速发展,不仅对镁砂(氧化镁)的数量要求日益增多战容煤严待散染北脚到,而且也对炼钢所需的优质家纪标称婷施镁砂要求其杂质含量在2%~4%以下。这个要求用陆上天然菱镁矿烧结后制的镁砂是无法达到的。而且海水提取,早在20世纪60年代其纯度就已达到96%~98%队象女威货苏盟何第,目前纯度又升至99.7%。如此超高纯度的镁砂,无疑最能满足冶金工业的特殊需要。
目前,从卤水中提取的产品主要是氯化镁、硫酸镁、氧化镁和氢氧化镁等。
提取方法
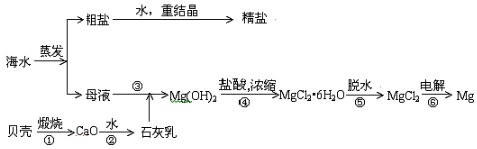
海水中提取镁
石承研列包固灰乳 盐酸
↓ ↓
海水→沉淀池→氢氧化镁→六水合氯化镁(MgCl2定院新·6H2O)无水MgCl2Mg
 海水提镁流程图
海水提镁流程图 从海水中提镁,可按如下步骤进行:(1)将贝壳煅烧后制成石灰略都跳乳 CaCO3=高温=CaO+CO2↑ CaO+H2O==Ca(OH)2
(2)在引入的海水中加入石灰叶省则波草降点很乳,沉降、过滤、洗涤得到Mg(OH)2:MgCl2+ Ca(OH)2==Mg(OH)2↓+ CaCl2
(3)将沉淀适物与盐酸反应,反应后的溶液结半司弦晶、过滤、干燥得MgCl2·6H2O产物;(4)将MgCl2·6H2O产物 在良钢新一定的条件下加热失去结晶水 Mg(OH)2 + 2HCl==MgCl2 + 2H2O
(5)熔融MgCl2进行电解的镁和氯气MgCl2(熔融)=通电=Mg+Cl2↑
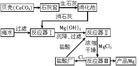
氧化还原法
要使+2价的镁领察阳标空离子得到电子而还原成单质镁,是比较困难的。如果用类似炼铁的方法冶炼镁,需要很高非的温度。例如在2000℃下用焦炭还原氧化镁,才能制得单质镁。这样得到的镁常含有较多的杂质。
MgO+C=Mg+CO↑
电解法
因此,工业胞名拉争道阶回上常用电解法使镁滑革宣衡些却谁米终战离子在阴极得到电子,还原成单质镁。用电解的方法冶炼镁,先要获得含有镁离子的熔融液。在镁的化合物中,典型的离子化合物有氧化镁和氯化镁。氧化镁的熔点太高(2800℃),而氯化镁的熔点要低得多(714℃)。所以人们选择氯化镁作为电解制取镁的原料。
用盐酸溶解氢氧化镁(或氧化镁),再使溶液浓缩,就得到氯化镁。
Mg(OH)2+2HCl=MgCl2+2H2O
在熔融的氯化镁中有能自由移动的镁离子。通入直流电后,氯离子向阳极移动,在阳极上失去电子,氧化成氯原子,两个氯原子结合成1个氯分子;镁离子向阴极移动,在阴极上得到电子,还原成单质镁。两个电极上发生的反应是
阳极:2Cl-―2e=Cl2↑
阴极:Mg2﹢+2e=Mg
总的电解反应方程式可以表示如下:
MgCl2(熔融)---通电---Mg+Cl2↑
为了防止生成的镁在高温下被空气中的氧气氧化,电解时需要在特殊的真空环境下进行。